��Ŀ����
7����ͼ���л�����õ���Ϣ�ǻ�ѧѧϰ���о�����Ҫ������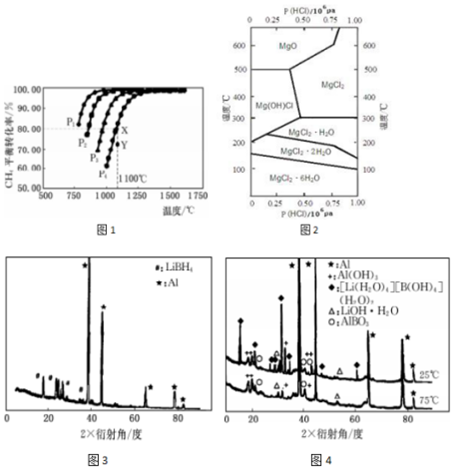
��1��ͼ1����һ�������£���Ӧ��CH4��g��+CO2��g��?2CO��g��+2H2��g����ʵ�����ߣ�
��ͼ1��P1��P2��P3��P4������ͬѹǿ��ѹǿ��С����P1���÷�Ӧ�ġ�H��0��ѡ���������������=������
��ѹǿΪ P4ʱ���� Y �㣺�ԣ��������ԣ��棩����ѡ���������������=������
��ѹǿΪP4ʱ���ܱ�������CH4��CO2����ʼŨ�Ⱦ�Ϊ0.10mol•L-1����1100��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ1.64��������λ��Ч���֣���
��2���¶���HClѹǿ��MgCl2•6H2O���ȷֽ�����Ӱ����ͼ2��ʾ������˵����ȷ����bd������ĸ��
a��Ҫ�õ�MgO��������Ҫ������600��
b���¶ȵ���100�棬P��HCl��С��1.00��106Paʱ��MgCl2•6H2O���ᷢ���ֽ�
c��Ҫ�õ���ˮMgCl2��ֻҪ�����¶ȣ���һ��Ҫ��HCl������
d����P��HCl��Ϊ0.25��106Paʱ��������������300�棬�����ķ�ӦΪMgCl2•6H2O�TMg��OH��Cl+HCl��+5H2O��
��3��X-��������������ж�ij��̬�����Ƿ���ڣ�Al-LiBH4�����Ͳ��⸴�ϲ��ϣ������¿�����H2O��Ӧ����H2��ͼ3�Ǻ�LiBH4Ϊ25%ʱAl-LiBH4���ϲ��ϵ�X-��������ͼ�ף�ͼ4�Ǹø��ϲ�����25���75��ʱ��ˮ��Ӧ������������ʵ�X-��������ͼ�ף���ͼ������25��ʱAl-LiBH4���ϲ�������ˮ��ȫ��Ӧ��������LiBH4���ѧʽ����25��ķ�Ӧ���75�淴Ӧ����������[Li��H2O��4][B��OH��4]��H2O��2 ���ѧʽ����
���� ��1������ͼ��֪���¶�һ��ʱ�������ת���ʦ���P1��������P2��������P3��������P4�����ݴ˽�Ϸ���ʽ�ж�ѹǿ��ƽ���ƶ���Ӱ����н��ѹǿһ��ʱ���¶�Խ�����ת����Խ�������¶�ƽ��������Ӧ���У��ݴ��жϣ�
����ͼ��֪��ѹǿΪP4��1100��������£�����ƽ��X��ʱ�����ת����Ϊ80%��Y������ת����С��80%����Ӧ������Ӧ���У��ݴ��жϣ�
����ͼ��֪��ѹǿΪP4��1100��������£�����ƽ��X��ʱ�����ת����Ϊ80%���ݴ˼�������Ũ�ȱ仯������������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ������¶��µ�ƽ�ⳣ����
��2��a����ͼ��֪P��HCl��g=0.25MPa���¶ȴ�300�����ߵ�500��ʱMgCl2•6H2O������Mg��OH��Clת���MgO��
b����ͼ��֪�¶ȵ���100�棬MgCl2•6H2O���ᷢ���ֽ⣻
c������MgCl2•6H2O���壬P��HCl��g��С��þ����ˮ������������þ���ò����Ȼ�þ����Ҫ�õ���ˮ�Ȼ�þ����Ӧͨ��HCl��������P��HCl��g������þ���ӵ�ˮ�⣻
d����ͼ��֪��HCl����ѹǿΪ0.25��106Paʱ���¶�������������300�棬�����ķ�ӦΪMgCl2•6H2O�TMg��OH��Cl+HCl+5H2O��
��3����ͼ��LiBH4��˵����ˮ��ȫ��Ӧ������ͼ��Աȷ���25���75��ʱ�����в���ͬ�����ʣ�
��� �⣺��1������ͼ��֪���¶�һ��ʱ�������ת���ʦ���P1��������P2��������P3��������P4�����÷�Ӧ����Ӧ�������������ķ�Ӧ������ѹǿƽ�����淴Ӧ���У������ת���ʽ��ͣ���ѹǿP4��P3��P2��P1��ѹǿһ��ʱ���¶�Խ�����ת����Խ�������¶�ƽ��������Ӧ���У�������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ��P1������
����ͼ��֪��ѹǿΪP4��1100��������£�����ƽ��X��ʱ�����ת����Ϊ80%��Y������ת����С��80%����Ӧ������Ӧ���У�����Y�㣺v��������v���棩��
�ʴ�Ϊ������
����ͼ��֪��ѹǿΪP4��1100��������£��ﵽƽ��X��ʱ�����ת����Ϊ80%�������Ũ�ȱ仯��Ϊ0.1mol/L��80%=0.08mol/L����
CH4��g��+CO2��g��=2CO��g��+2H2��g����
��ʼ��mol/L����0.1 0.1 0 0
�仯��mol/L����0.08 0.08 0.16 0.16
ƽ�⣨mol/L����0.02 0.02 0.16 0.16
�ʸ��¶���ƽ�ⳣ��k=$\frac{0.1{6}^{2}��0.1{6}^{2}}{0.02��0.02}$=1.64���ʴ�Ϊ��1.64��
��2��a����ͼ��֪P��HCl��g=0.25MPa���¶ȴ�300�����ߵ�500��ʱMgCl2•6H2O������Mg��OH��Clת���MgO����a����
b����ͼ��֪�¶ȵ���100�棬MgCl2•6H2O���ᷢ���ֽ⣬��b��ȷ��
c������MgCl2•6H2O���壬P��HCl��g��С��þ����ˮ������������þ���ò����Ȼ�þ����Ҫ�õ���ˮ�Ȼ�þ����Ӧͨ��HCl��������P��HCl��g������þ���ӵ�ˮ�⣬��c����
d����ͼ��֪��HCl����ѹǿΪ0.25��106Paʱ���¶�������������300�棬�����ķ�ӦΪMgCl2•6H2O�TMg��OH��Cl+HCl+5H2O����d��ȷ��
��ѡ��bd��
��3����ͼ��LiBH4��˵����ˮ��ȫ��Ӧ����ͼ��25���75��ʱ����Ա��в���ͬ������Ϊ[Li��H2O��4][B��OH��4]��H2O��2��
�ʴ�Ϊ��LiBH4��[Li��H2O��4][B��OH��4]��H2O��2��
���� ���⿼�黯ѧƽ��ͼ��Ӱ�컯ѧƽ������ء���ѧƽ�ⳣ���Լ�ͼ����Ϣ����ȡ�ȣ���Ŀ�Ѷ��еȣ�ע�����á���һ�����ԭ������������ѧ������ͼ����ȡ��Ϣ��������

 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д� ״Ԫ����ϵ�д�
״Ԫ����ϵ�д� ͬ������ϵ�д�
ͬ������ϵ�д�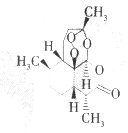 �й���ҽ�о�Ժ�����о�Ա����ϯ�о�Ա��������1971�����ȴӻƻ����з��ֿ�ű��Ч��ȡ�1972���������ͽṹ�Ŀ�ű��Ч�ɷ������أ���������ǧ���˵������������صķ��ӽṹ��ͼ������˵�Ӵ�����ǣ�������
�й���ҽ�о�Ժ�����о�Ա����ϯ�о�Ա��������1971�����ȴӻƻ����з��ֿ�ű��Ч��ȡ�1972���������ͽṹ�Ŀ�ű��Ч�ɷ������أ���������ǧ���˵������������صķ��ӽṹ��ͼ������˵�Ӵ�����ǣ�������| A�� | �����صķ���ʽΪC15H22O5 | |
| B�� | �������Ƿ����廯���� | |
| C�� | �����ط����к��й��������������Ѽ� | |
| D�� | �����ز��ܷ����ӳɷ�Ӧ |
| A�� | Ũ������Ũ�����ڿ����г��ڷ���ʱŨ�Ⱦ���С | |
| B�� | ����������������Һ���� | |
| C�� | �ھ�ˮ�����зֱ�ʹ��������Ư�� | |
| D�� | ��ҵ����ȡ�������ͽ���ͭ |
| A�� | ԭ�Ӱ뾶�Ĵ�С˳��r��Z����r��Y����r��X�� | |
| B�� | ���⻯����ȶ��ԣ�W��Z | |
| C�� | Ԫ��X�ĵ���ֻ��������ͬ�������� | |
| D�� | X��Y��W����������Ӧ��ˮ��������֮���ܷ�����Ӧ |
| A�� | NH4Cl�ĵ���ʽ��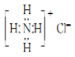 | |
| B�� | ���Ȼ�̼�������ģ�ͣ�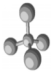 | |
| C�� | ��ϩȩ�Ľṹ��ʽ��CH3CH2COH | |
| D�� | ̼��������ӵ�ˮ�ⷽ��ʽ��HCO3-+H2O?CO32-+H3O |
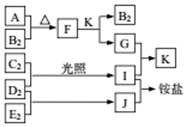 ��ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯�������Һ����ת����ϵ����֪����B2��C2��D2��E2�ڳ��³�ѹ�²������壬������G����ɫ��ӦΪ��ɫ��������I��J��Kͨ��״���³���̬������˵����ȷ���ǣ�������
��ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯�������Һ����ת����ϵ����֪����B2��C2��D2��E2�ڳ��³�ѹ�²������壬������G����ɫ��ӦΪ��ɫ��������I��J��Kͨ��״���³���̬������˵����ȷ���ǣ�������| A�� | B�⻯��ķе������ͬ��������Ԫ���⻯��ķе� | |
| B�� | ԭ�Ӱ뾶��С��A��C��B��E��D | |
| C�� | F�мȺ������Ӽ��ֺ��м��Թ��ۼ� | |
| D�� | G�е�������������ˮ�ĵ��� |
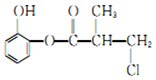
| A�� | �л���A��Ũ�����ϼ��ȣ����Է�����ȥ��Ӧ | |
| B�� | 1 molA ��������H2�����ӳɷ�Ӧ������������4mol H2 | |
| C�� | 1 molA ��������NaOH ��Һ��ַ�Ӧ������������4 mol NaOH | |
| D�� | �л���A ��ͬ���칹��������ϡ���������ˮ�����ɶ����ӵ���6 �� |
| A�� | ��ɫ��������Һ�У�H+��Cu2+��SO42-��Cl- | |
| B�� | 0.1 mol•L-1AlCl3��Һ�У�H+��Na+��Cl-��SO42- | |
| C�� | pH=13����Һ�У�NH4+��K+��NO3-��HCO3- | |
| D�� | c����OH-����$\sqrt{{K}_{w}}$����Һ��Ca2+��Fe2+��NO3-��ClO- |
| A�� | ICl+H2O=HCl+HIO | B�� | 2K+2H2O=2KOH+H2�� | ||
| C�� | 2F2+2H2O=4HF+O2 | D�� | 2Na2O2+2H2O=4NaOH+O2 |