题目内容
3.实验室欲配制150mL 0.2mol•L-1NaOH溶液:①应用托盘天平称取NaOH固体2.0g;
②配制NaOH溶液时需要用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管.
③下列操作结果,使所配制溶液物质的量浓度偏高的是B.
A.将NaOH放在纸张上称量
B.定容时俯视刻度线
C.定容时仰视刻度线
D.容量瓶用蒸馏水洗涤后未干燥即用来配制溶液
④配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处.
分析 ①依据配制溶液体积选择合适的容量瓶,依据m=CVM计算需要溶质的质量;
②依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
③分析操作对溶质的物质量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
④配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,据此排序.
解答 解:①配制150mL 0.2mol•L-1NaOH溶液,应选择250mL容量瓶,需要氢氧化钠的质量m=0.2mol/L×40g/mol×0.25L=2.0g;
故答案为:2.0;
②配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
故答案为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
③A.将NaOH放在纸张上称量,导致称取的溶质质量偏小,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.容量瓶用蒸馏水洗涤后未干燥即用来配制溶液,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故D不选;
故选:B;
④配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,所以正确的顺序为:BCAFED;
故答案为:BCAFED.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.

练习册系列答案
相关题目
13.下列各组离子中,在酸性溶液中能大量共存且溶液为无色透明的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Na+、HCO3-、Cl-、NO3- | ||
| C. | Na+、SO32-、NO3-、K+ | D. | K+、SO42-、Mg2+、Cl- |

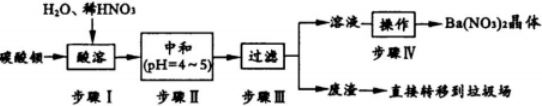
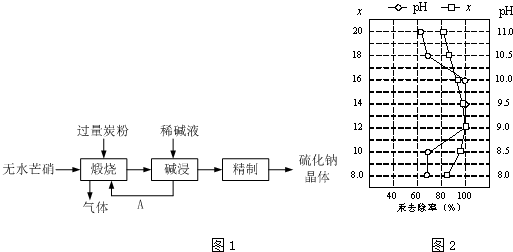
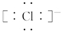 .Al在元素周期表最中的位置是第三周期第IIIA族.
.Al在元素周期表最中的位置是第三周期第IIIA族.