题目内容
18.无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还 含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2?4AlCl3+3O2回答以下问题:
(1)Cl-的电子式为
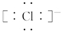 .Al在元素周期表最中的位置是第三周期第IIIA族.
.Al在元素周期表最中的位置是第三周期第IIIA族.(2)生产中加入石油焦,其目的是碳与O2反应,有利于反应正向进行.
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2═AlCl3+X↑,设计实验确定气体X的成分:
气体X可能为CO、CO2或两者的混合物,将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO;.
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2.
(5)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①过程涉及的离子方程式Fe3++3OH-═Fe(OH)3↓、Al3++4OH-═AlO2-+2H2O.
②AlCl3产品的纯度为96%.
(6)以铝土矿为原料可以通过以下途径提纯氧化铝:
过量NaOH溶液过量稀盐酸过量氨水
①写出滤液甲中溶质的化学式NaAlO2、Na2SiO3、NaOH.
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
分析 (1)氯离子最外层达到8电子稳定结构,注意在写阴离子的电子式时注意不要忘记写中括号和中括号外的电荷符号;铝元素核电荷数为13,位于周期表中第三周期第IIIA族;
(2)根据化学方程式2Al2O3+6Cl2=4AlCl3+3O2可知,该反应为可逆反应,加入石油焦后,碳与O2反应,有利于反应正向进行;
(3)根据反应方程式可知,气体X可能为一氧化碳、二氧化碳或者二者混合物,可以利用澄清石灰水检验二氧化碳,利用灼热的氧化铜检验一氧化碳,据此涉及实验方案;
(4)根据题中信息可知,反应物为Al和FeCl3,反应产物为氯化铝和FeCl2,据此写出反应的化学方程式;
(5)①根据铝离子、铁离子与过量的氢氧根离子反应生成偏铝酸根离子、氢氧化铁沉淀写出反应的离子方程式;
②残留固体质量为0.32g为氧化铁,可以计算出铁离子的物质的量及氯化铁的质量,最后根据总质量计算出氯化铝的纯度;
(6)①过量NaOH溶液可以和铝土矿中的Al2O3和SiO2 反应,不与Fe2O3 反应,可知滤液甲的成分,注意氢氧化钠是过量的;
②滤液乙中含有铝离子,铝离子与氨水反应生成难溶物氢氧化铝,据此写出反应的离子方程式.
解答 解:(1)氯离子最外层达到了8电子稳定结构,氯离子的电子式为: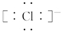 ;铝元素为主族元素,核外3个电子层,位于周期表中第三周,最外层3个电子,位于第IIIA族,
;铝元素为主族元素,核外3个电子层,位于周期表中第三周,最外层3个电子,位于第IIIA族,
故答案为: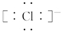 ;第三周期第IIIA族;
;第三周期第IIIA族;
(2)从生产无水AlCl3的化学方程式看,该反应为可逆反应,加入石油焦后,碳与O2反应,使可逆反应转化为不可逆反应,有利于反应正向进行,
故答案为:碳与O2反应,有利于反应正向进行;
(3)从Al2O3+C+Cl2=AlCl3+X↑可以看出X为CO、CO2或两者的混合物,确定气体X的成分,就是检验CO、CO2的存在,检验方法为:气体X可能为CO、CO2或两者的混合物,将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO,
故答案为:气体X可能为CO、CO2或两者的混合物,将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO;
(4)铝将氯化铁还原为氯化亚铁,反应的化学方程式为:Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2,
故答案为:Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2;
(5)①该制取过程中涉及的离子方程式有AlCl3与过量的NaOH溶液的反应和FeCl3与NaOH溶液的反应,反应的离子方程式为:Fe3++3OH-═Fe(OH)3↓;Al3++4OH-═AlO2-+2H2O,
故答案为:Fe3++3OH-═Fe(OH)3↓;Al3++4OH-═AlO2-+2H2O;
②0.32 g残留固体质量是Fe2O3,则铁离子的物质的量为:n(Fe3+)=0.004 mol,氯化铁的质量为:m(FeCl3)=162.5g/mol×0.004mol=0.65 g,混合物中氯化铝的质量为:m(AlCl3)=16.25g-0.65g=15.6 g,所以AlCl3产品的纯度为:$\frac{15.6g}{16.25g}$×100%=96%,
故答案为:96%;
(6)①铝土的主要成分是Al2O3和Fe2O3,还含有少量的SiO2,加入氢氧化钠溶液后,氧化铝、二氧化硅与氢氧化钠溶液反应生成偏铝酸根离子和硅酸钠,氧化铁不反应,所以滤液甲中的溶质为:NaAlO2、Na2SiO3、NaOH,
故答案为:NaAlO2、Na2SiO3、NaOH;
②根据流程可知,滤液乙中含有铝离子,铝离子与氨水反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
点评 本题考查了影响化学平衡因素、物质的分离与提纯、探究物质组成与含量等知识,题目难度中等,试题涉及的题量过大,知识点较多,充分考查了学生对所学知识的掌握情况;解答本题时需要合理、耐心分析题中信息、制取流程,然后联系所学知识进行作答,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是盛有NaCl溶液的试管.
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠
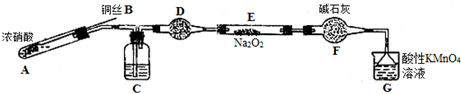
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4- 反应生成NO3-和Mn2+
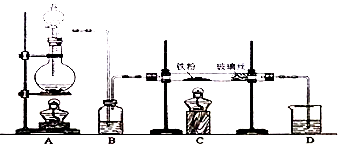
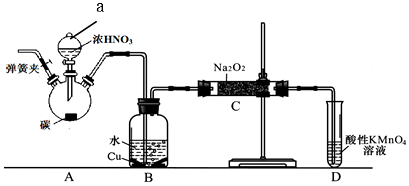
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
 葡萄可用于酿酒.
葡萄可用于酿酒.