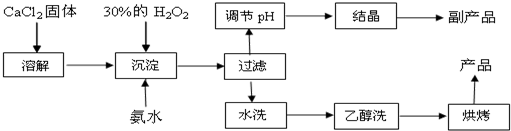
题目内容
14.Ba(NO3)2可用于生产烟花.某化工厂利用BaCO3【含少量CuCO3、Ba(FeO2)2等杂质】制取Ba(NO3)2晶体,其部分工艺流程如图所示.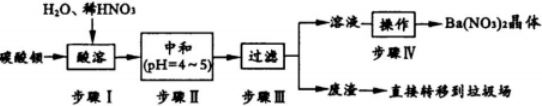
已知:Fe3+和Fe2+ 以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7.
(l)Ba(FeO2)2中Fe的化合价为+3;在步骤I中HNO3表现出的性质是酸性.
(2)检验步骤Ⅲ所得溶液是否含铁元素的方法是取少量溶液于试管,滴加几滴KSCN溶液,振荡,如果溶液出现红色则含有Fe3+,否则不含Fe3+.
(3)步骤IV中得到Ba(NO3)2晶体的操作依次为蒸发浓缩,冷却结晶,过滤;该厂生产的Ba(NO3)2晶体含有少量Cu2+.化学上通过惰性电解法富集Cu时,发现电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成.生成该气体的电极反应为NO3-+6H2O+8e-=NH3↑+9OH-.
(4)闪光粉是由Ba(NO3)2与Al粉混合而成,受热可以产生N2和另外两种氧化物,同时放出大量光和热.
已知:4NO2(g)+O2(g)+2BaO(s)=2Ba(NO3)2(s)△H=+a kJ/mol
4Al(s)+3O2 (g)=2Al2O3 (s)△H=-b kJ/mol
N2(g)+2O2(g)=2NO2 (g)△H=-c kJ/mol (a、b、c均大于0)
则反应:3Ba(NO3)2(s)+10Al(s)=3N2(g)+5Al2O3(s)+3BaO(s)△H=-(1.5a+2.5b-3c)kJ/mol.
(5)Ba2+半致死量为355mg/kg.误食Ba2+可以服用MgSO4溶液解毒,涉及到的离子反应方程式为Ba2++SO42-=BaSO4↓.
分析 BaC03含少量CuC03、Ba(FeO2)2等杂质,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成Fe(OH)3沉淀、Cu(OH)2沉淀,过滤后废渣为Fe(OH)3、Cu(OH)2,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤可得到硝酸钡晶体,
(1)Ba(FeO2)2中钡元素为+2价,铁元素为+3价,步骤I中发生的反应都不是氧化还原反应,在产物中生成的都是硝酸盐,则硝酸只体现了酸性;
(2)检验三价铁通常用硫氰化钾溶液;
(3)步骤IV中得到Ba(N03)z晶体的操作依次为蒸发浓缩,冷却结晶,过滤;阴极发生还原反应,能使红色石蕊试纸变蓝的气体是氨气,说明是溶液中硝酸根放电;
(4)闪光粉是由Ba(N03)2与Al粉混合而成,受热可以产生N2和另外两种氧化物,利用化合价升降配平方程式为:3Ba(NO3)2+10Al=3N2+5Al2O3+3BaO,
①4NO2 (g)+O2 (g)+2BaO(s)=2Ba(N03)2(s)△H=+akJ/mol
②4Al(s)+302 (g)=2Al203(s)△H=-bkJ/mol
③N2 (g)+2O2(g)=2N02 (g)△H=-ckJ/mol
用盖斯定律构造目标反应,应是②×2.5-③×3-①×1.5得到热化学反应方程式;
(5)Ba2+可以服用MgS04溶液解毒,涉及到的离子反应方程式为:Ba2++SO42-=BaSO4↓;
解答 解:(1)Ba(FeO2)2中钡元素为+2价,铁元素为+3价,步骤I中HN03与BaC03、CuC03发生复分解反应,与Ba(FeO2)2反应的方程式为:Ba(FeO2)2+8HNO3 =Ba(NO3)2+2Fe(NO3)3+4H2O,这些反应中各元素化合价都没有变化,都不是氧化还原反应,在产物中生成的都是硝酸盐,则硝酸只体现了酸性,
故答案为:+3;酸性;
(2)检验三价铁通常用硫氰化钾溶液,具体操作是:取少量溶液于试管,滴加几滴KSCN溶液,振荡,如果溶液出现红色则含有Fe3+,否则不含Fe3+,
故答案为:取少量溶液于试管,滴加几滴KSCN溶液,振荡,如果溶液出现红色则含有Fe3+,否则不含Fe3+;
(3)步骤IV中得到Ba(N03)z晶体的操作依次为蒸发浓缩,冷却结晶,过滤;阴极发生还原反应,能使红色石蕊试纸变蓝的气体是氨气,说明是溶液中硝酸根放电,则电极反应式为:NO3-+6H2O+8e-=NH3↑+9OH-,
故答案为:蒸发浓缩,冷却结晶,过滤;NO3-+6H2O+8e-=NH3↑+9OH-;
(4)闪光粉是由Ba(N03)2与Al粉混合而成,受热可以产生N2和另外两种氧化物,利用化合价升降配平方程式为:3Ba(NO3)2+10Al=3N2+5Al2O3+3BaO,
①4NO2 (g)+O2 (g)+2BaO(s)=2Ba(N03)2(s)△H=+akJ/mol
②4Al(s)+302 (g)=2Al203(s)△H=-bkJ/mol
③N2 (g)+2O2(g)=2N02 (g)△H=-ckJ/mol
用盖斯定律构造目标反应,应是②×2.5-③×3-①×1.5,得到3Ba(NO3)2(s)+10Al(s)=3N2(g)+5Al2O3(s)+3BaO(s)△H=-(1.5a+2.5b-3c)kJ/mol,
故答案为:-(1.5a+2.5b-3c)kJ/mol;
(5)Ba2+可以服用MgS04溶液解毒,涉及到的离子反应方程式为:Ba2++SO42-=BaSO4↓;过滤得到的废渣上含硝酸,应洗涤废渣并回收洗涤液,
故答案为:Ba2++SO42-=BaSO4↓;
点评 本题考查学生在“工艺流程阅读、相关化学反应、除杂的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是盛有NaCl溶液的试管.
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠
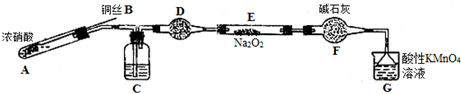
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4- 反应生成NO3-和Mn2+
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是浓氨水 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是H2S |
 某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下列所示实验装置制取乙酸乙酯.回答以下问题: