题目内容
5.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入H2O2后溶液变成血红色,说明Fe2+可被过氧化氢氧化生成铁离子;
B.常温下铜与浓硫酸不反应;
C.硫酸钡和硫酸钙都为白色沉淀;
D.酸性条件下,硝酸根离子可氧化二氧化硫生成硫酸根离子.
解答 解:A.加入H2O2后溶液变成血红色,说明Fe2+可被过氧化氢氧化生成铁离子,该实验只能说明亚铁离子的还原性,不能说明氧化性,故A错误;
B.常温下铜与浓硫酸不反应,现象、结论都不正确,故B错误;
C.硫酸钡和硫酸钙都为白色沉淀,不能确定沉淀的成分,则不能比较溶度积大小,故C错误;
D.酸性条件下,硝酸根离子可氧化二氧化硫生成硫酸根离子,可生成硫酸钡沉淀,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及沉淀生成、物质的检验等知识点,为高频考点,侧重分析、实验及应用能力的综合考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
15.已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)=BaSO4(s)△H3<0
下列说法正确的是( )
①HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)=BaSO4(s)△H3<0
下列说法正确的是( )
| A. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
13.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为( )
| A. | 175 | B. | 47 | C. | 118 | D. | 57 |
20.药物阿司匹林可由水杨酸制得,它们的结构如图所示.有关说法正确的是( )


| A. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 |
17.下列微粒的结构示意图中氧族元素原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
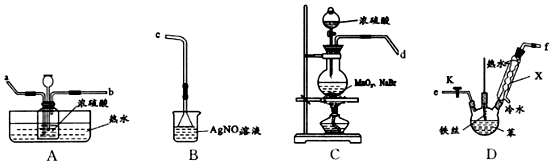
 ;仪器X的名称为球形冷凝管.
;仪器X的名称为球形冷凝管. ?
?
 ;
; 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.