题目内容
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
分析 A.重水的摩尔质量为20g/mol,重水中含有10个质子,4.0g重水的物质的量为0.2mol,含有2mol质子;
B.气体状况未知;
C.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
D.稀硫酸与铜不反应.
解答 解:A.4.0g重水(D2O)的物质的量为0.2mol,0.2mol重水中含有2mol质子,所含质子数为2NA,故A正确;
B.气体状况未知,Vm不确定,不能使用气体摩尔体积,故B错误;
C.氧气与臭氧都是由氧原子构成,16g的氧气与臭氧混合气体中,氧原子数为$\frac{16g}{16g/mol}$×NA=NA,故C正确;
D.随着反应进行浓硫酸浓度降低,变为稀硫酸,稀硫酸与铜不反应,所以12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数小于0.2NA,故D错误;
故选:AC.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下常见物质的状态及标况下气体摩尔体积的使用条件是解题关键,注意硫酸与铜反应条件,题目难度中等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
5.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
2.分子式为C5H10O2且可NaHCO3溶液反应生成CO2的有机化合物有(不含立体异构)( )
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 9种 |
9.NA表示阿佛加德罗常数的值,下列关于0.2mol/LK2SO4溶液的说法正确的是( )
| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+浓度为0.2 mol/L | |
| D. | 1L溶液中SO42-的浓度为0.4 mol/L |
19.向含有a mol NaOH和a mol Ba(OH)2的混合液中通入b mol CO2气体,充分反应后(忽略水解对离子浓度变化的影响),下列说法不正确的是( )
| A. | 当a=b时,发生的离子总反应为:2OH-+CO2+Ba2+═BaCO3↓+H2O | |
| B. | 当3a=2b时,发生的离子总反应为:6OH-+3CO2+2Ba2+═2BaCO3↓+3H2O+CO32- | |
| C. | 当$\frac{3}{2}$a<b<3a时,溶液中含有n(CO32-):n(HCO3-)=(3a-b):(2b-3a) | |
| D. | 当3a=b时,溶液中Na+、Ba2+与HCO3-的物质的量之比为1:1:3 |
6.已知还原性SO32->I-,某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍无色.则下列关于该溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
3.NaClO溶液可用于漂白,其漂白速率随pH降低逐渐增大,当pH<4时,漂白速率增大更快,此时起漂白作用的主要是Cl2.下列说法不正确的是( )
| A. | 保存NaClO溶液时加入少量NaOH可以抑制水解 | |
| B. | pH<4时,起漂白作用的Cl2是HClO分解产生的 | |
| C. | 随pH降低,溶液中HClO和Cl2增多,所以漂白速率加快 | |
| D. | 用NaClO溶液漂白色素时,不同条件下由不同成分起到漂白作用 |
2.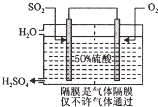 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A.二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的是98.3%的浓硫酸
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通人的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是400℃.1个标准大气压.
(5)硫酸工厂排放的尾气中,含少量二氧化硫.为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用.硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理.
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可再利用作为原料
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰50kg.
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A.二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的是98.3%的浓硫酸
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通人的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是400℃.1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可再利用作为原料
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰50kg.
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.