题目内容
15.已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)=BaSO4(s)△H3<0
下列说法正确的是( )
| A. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
分析 A.利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B.中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量;
C.H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热;
D.稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ.
解答 解:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,△H<0,故A错误;
B.中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量,和盐酸、氢氧化钠的用量无关,故B错误;
C.H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成1mol水和可溶盐的中和热,故C正确;
D.稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ,焓变为负值,则该反应的△H<-114.6 kJ•mol-1,故D错误;
故选C.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确化学反应与能力变化的关系即可解答,注意掌握盖斯定律的内容及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.短周期元素W、Q、X、Y在元素周期表中的位置如图,其中X是两性金属元素.则( )
| W | Q | ||
| X | Y |
| A. | 简单离子半径:X<Q | B. | 气态氢化物的稳定性:Y>Q | ||
| C. | X的族序数大于周期数 | D. | Y氧化物对应水化物是强酸 |
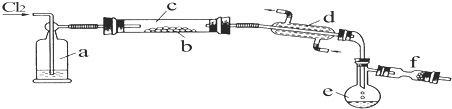
1.利用石墨电极电解1mol/L氯化钠溶液,并收集阳极气体检验其成分.已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.
实验:
①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
实验:
①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 根据实验现象可以判断电解时阳极的电极反应式为:2Cl--2e-═Cl2↑ |
10.已知两瓶气体,分别是HCl和Cl2.可以区别它们的方法或试剂是( )
①观察颜色 ②打开瓶盖看有无白雾 ③硝酸银溶液 ④湿润的红色石蕊试纸 ⑤湿润的蓝色石蕊试纸.
①观察颜色 ②打开瓶盖看有无白雾 ③硝酸银溶液 ④湿润的红色石蕊试纸 ⑤湿润的蓝色石蕊试纸.
| A. | ①②③④ | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②④ |
20.两份铝屑,第一份与足量盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1:1,则消耗的盐酸和氢氧化钠的物质的量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
5.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
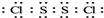 .
. .
. 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.