题目内容
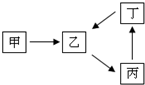 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.(1)若乙是难溶于水的酸性氧化物.
①乙的一种重要用途是
②丙溶液中通入少量CO2生成丁的离子方程式是
(2)若2乙(g)+甲(g)?2丙(g),是工业生产中重要反应之一.
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1
(3)若丙是离子化合物,且阴离子含金属元素R.
①R的原子结构示意图是
②已知:R(s)+
| 3 |
| 4 |
| 1 |
| 2 |
Mn(s)+O2(g)=MnO2(s)△H=-520.9kJ?mol-1
写出R的单质与MnO2反应的热化学方程式
考点:无机物的推断
专题:推断题
分析:甲是地壳中含量最高的元素组成的单质,可推知甲为O2,化合物乙、丙、丁均含有第三周期一种相同元素,
(1)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3;
(2)若2乙(g)+甲(g)?2丙(g),是工业生产中重要反应之一,为二氧化硫催化氧化生成三氧化硫,可推知乙为SO2,丙为SO3,由转化关系可知,丁为H2SO4.由表中数据可知,升高温度乙的转化率减小,平衡向逆反应方向移动,据此判断解答;
(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3,根据盖斯定律书写热化学方程式.
(1)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3;
(2)若2乙(g)+甲(g)?2丙(g),是工业生产中重要反应之一,为二氧化硫催化氧化生成三氧化硫,可推知乙为SO2,丙为SO3,由转化关系可知,丁为H2SO4.由表中数据可知,升高温度乙的转化率减小,平衡向逆反应方向移动,据此判断解答;
(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3,根据盖斯定律书写热化学方程式.
解答:
解:甲是地壳中含量最高的元素组成的单质,可推知甲为O2,化合物乙、丙、丁均含有第三周期一种相同元素,
(1)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3,则:
①乙为SiO2,可以用作制造光导纤维或生产玻璃等,故答案为:制造光导纤维或生产玻璃等;
②丙溶液中通入少量CO2生成丁的离子方程式是SiO32-+CO2+H2O=H2SiO3↓+CO32-,故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(2)若2乙(g)+甲(g)?2丙(g),是工业生产中重要反应之一,为二氧化硫催化氧化生成三氧化硫,可推知乙为SO2,丙为SO3,由转化关系可知,丁为H2SO4.
①由表中数据可知,升高温度乙的转化率减小,平衡向逆反应方向移动,则正反应为放热反应,即△H<0,
故答案为:<;②升高温度平衡向逆反应方向移动,平衡常数减小,平衡常数若400℃和500℃的化学平衡常数分别为K1、K2,则K1>K2,故答案为:>;
(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3,则:
①Al的原子结构示意图是 ,故答案为:
,故答案为: ;
;
②Al的单质与MnO2反应生成Mn与Al2O3,
已知:①Al(s)+
O2(g)=
Al2O3(s)△H=-834.8kJ?mol-1
②Mn(s)+O2(g)=MnO2(s)△H=-520.9kJ?mol-1
根据盖斯定律,①-②×
得Al单质与MnO2反应生成Mn与Al2O3的热化学方程式为:Al(s)+
MnO2(s)=
Al2O3(s)+
Mn(s)△H=-444.125 kJ?mol-1,
故答案为:Al(s)+
MnO2(s)=
Al2O3(s)+
Mn(s)△H=-444.125 kJ?mol-1.
(1)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3,则:
①乙为SiO2,可以用作制造光导纤维或生产玻璃等,故答案为:制造光导纤维或生产玻璃等;
②丙溶液中通入少量CO2生成丁的离子方程式是SiO32-+CO2+H2O=H2SiO3↓+CO32-,故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(2)若2乙(g)+甲(g)?2丙(g),是工业生产中重要反应之一,为二氧化硫催化氧化生成三氧化硫,可推知乙为SO2,丙为SO3,由转化关系可知,丁为H2SO4.
①由表中数据可知,升高温度乙的转化率减小,平衡向逆反应方向移动,则正反应为放热反应,即△H<0,
故答案为:<;②升高温度平衡向逆反应方向移动,平衡常数减小,平衡常数若400℃和500℃的化学平衡常数分别为K1、K2,则K1>K2,故答案为:>;
(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3,则:
①Al的原子结构示意图是
 ,故答案为:
,故答案为: ;
;②Al的单质与MnO2反应生成Mn与Al2O3,
已知:①Al(s)+
| 3 |
| 4 |
| 1 |
| 2 |
②Mn(s)+O2(g)=MnO2(s)△H=-520.9kJ?mol-1
根据盖斯定律,①-②×
| 3 |
| 4 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
故答案为:Al(s)+
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
点评:本题以无机物推断为载体,考查元素化合物性质、常用化学用语、化学平衡与平衡常数影响因素、热化学方程式书写等,难度不大,注意对基础知识的全面掌握.

练习册系列答案
相关题目
NA为阿伏伽德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 L水含有的水分子数为NA |
| B、常温常压下,22 g CO2含有的CO2分子数为0.5NA |
| C、标准状况下,1 mol CH4分子的电子数为8 NA |
| D、物质的量浓度为1mol/L的AlCl3溶液中,Cl- 的物质的量浓度为1mol/L |
下列离子在溶液中不能大量共存的是( )
A、K+、MnO
| ||
B、OH-、AlO
| ||
C、AlO
| ||
D、K+、SO
|
下列反应的离子方程式书写正确的是( )
| A、向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B、将碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
| C、将1 mol?L-1的NaAlO2溶液和2.5 mol?L-1的HCl溶液等体积均匀混合:AlO2-+H++H2O=Al(OH)3↓ |
| D、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至Al3+恰好完全沉淀2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |

 2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!