题目内容
NA为阿伏伽德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 L水含有的水分子数为NA |
| B、常温常压下,22 g CO2含有的CO2分子数为0.5NA |
| C、标准状况下,1 mol CH4分子的电子数为8 NA |
| D、物质的量浓度为1mol/L的AlCl3溶液中,Cl- 的物质的量浓度为1mol/L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况下水的状态不是气体,题中条件无法计算水的物质的量;
B、根据n=
计算出二氧化碳的物质的量及含有的分子数;
C、1mol甲烷中含有10mol电子;
D、根据氯化铝溶液的浓度及氯化铝的化学式计算出氯离子物质的量浓度.
B、根据n=
| m |
| M |
C、1mol甲烷中含有10mol电子;
D、根据氯化铝溶液的浓度及氯化铝的化学式计算出氯离子物质的量浓度.
解答:
解:A、标况下,水不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故A错误;
B、22g二氧化碳的物质的量为0.5mol,0.5mol二氧化碳中含有的CO2分子数为0.5NA,故B正确;
C、1mol甲烷中含有10mol电子,含有的电子数为10NA,故C错误;
D、1mol/L的AlCl3溶液中,氯离子浓度为3mol/L,故D错误;
故选B.
B、22g二氧化碳的物质的量为0.5mol,0.5mol二氧化碳中含有的CO2分子数为0.5NA,故B正确;
C、1mol甲烷中含有10mol电子,含有的电子数为10NA,故C错误;
D、1mol/L的AlCl3溶液中,氯离子浓度为3mol/L,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A、22.4 L CO2与CO的混合气体中含碳原子数为NA |
| B、常温下,1L 0.1 mol?L-1的NH4NO3溶液中氮原子数为0.2 NA |
| C、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
| D、在铁参与的反应中,5.6 g铁完全反应失去的电子数一定为0.3 NA |
下列离子方程式书写正确的是( )
A、碳酸氢钠溶液呈碱性:HCO
| ||||
| B、FeS固体放入稀硝酸中:FeS+2H+=Fe2++H2S↑ | ||||
C、用饱和碳酸钠溶液多次浸取BaSO4固体:BaSO4+CO
| ||||
D、向KHCO3溶液中滴入少量的Ba(OH)2溶液:HC
|
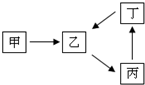 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.