题目内容
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族,丙为无色气体.X、A、B、C、D、E、F、G均为常见化合物,其中A和X的摩尔质量相同,G的焰色反应为黄色.在一定条件下,各物质相互转化关系如下图:

请回答:
(1)写出下列物质的化学式:丙为 ,C为 .
(2)写出X的电子式 .
(3)写出A与水反应的化学方程式 .
(4)写出B与G溶液反应的离子方程式 .

请回答:
(1)写出下列物质的化学式:丙为
(2)写出X的电子式
(3)写出A与水反应的化学方程式
(4)写出B与G溶液反应的离子方程式
考点:无机物的推断
专题:推断题
分析:甲、乙、丙为常见单质,结合转化关系和反应条件可知丙为O2,甲和丙反应生成的A焰色反应为黄色证明甲为金属钠Na,A为Na2O2,F为Na2CO3;B为NaOH,G的焰色反应为黄色,判断G为NaHCO3;乙、丙两元素在周期表中位于同一主族,判断乙为S,所以X为Na2S,A和X的摩尔质量相同为78g/mol;依据转化关系可知D为SO2,E为SO3;E(SO3)+B(NaOH)=C(Na2SO4)依据判断出的物质进行分析回答问题.
解答:
解:甲、乙、丙为常见单质,结合转化关系和反应条件可知丙为O2,甲和丙反应生成的A焰色反应为黄色证明甲为金属钠Na,A为Na2O2,F为Na2CO3;B为NaOH,G的焰色反应为黄色,判断G为NaHCO3;乙、丙两元素在周期表中位于同一主族,判断乙为S,所以X为Na2S,A和X的摩尔质量相同为78g/mol;依据转化关系可知D为SO2,E为SO3;E(SO3)+B(NaOH)=C(Na2SO4);
(1)依据判断可知丙为O2,C为Na2SO4,故答案为:O2;Na2SO4;
(2)X为Na2S,是离子化合物,化合物的电子式为: ,故答案为:
,故答案为: ;
;
(3)A(Na2O2)与H2O反应的化学反应方程式为:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)B和G是氢氧化钠和碳酸氢钠溶液的反应,反应的离子方程式为:HCO3-+H+=CO32-+H2O,故答案为:HCO3-+H+=CO32-+H2O.
(1)依据判断可知丙为O2,C为Na2SO4,故答案为:O2;Na2SO4;
(2)X为Na2S,是离子化合物,化合物的电子式为:
 ,故答案为:
,故答案为: ;
;(3)A(Na2O2)与H2O反应的化学反应方程式为:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)B和G是氢氧化钠和碳酸氢钠溶液的反应,反应的离子方程式为:HCO3-+H+=CO32-+H2O,故答案为:HCO3-+H+=CO32-+H2O.
点评:本题考查了物质转化关系的综合应用,物质性质的应用,反应现象的判断和特征应用,主要是考查物质转化的特征反应和条件判断,掌握常见物质的性质和反应特征、反应条件是解题关键.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
不能用离子方程式 CO32-+2H+═CO2↑+H2O表示的反应是( )
| A、K2CO3+2HNO3═2KNO3+CO2↑+H2O |
| B、Na2CO3+2HCl═2NaCl+CO2↑+H2O |
| C、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| D、(NH4)2CO3+H2SO4═(NH4)2SO4+CO2↑+H2O |
用NA表示阿伏加德罗常数,32g O2含有的氧原子数为( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、1L 0.1mol?L-1的氯化铵溶液中有nA个NH4+ |
| B、标准状况下,22.4L SO3含有nA个SO3分子 |
| C、常温常压下,8g O2含有0.5nA个氧原子(O:16) |
| D、1mol Na被完全氧化生成Na2O2,失去2nA个电子 |

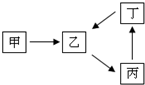 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.