题目内容
A、B、C、D、E是中学常见的五种化合物,A、B是氧化物,X、Y是生活中常见的金属,相关物质间的关系如图所示(某些条件已略去).

(1)若试剂a是NaOH溶液,
①C的名称是 ;
②B与试剂a反应的离子方程式是 .
(2)若试剂b是稀H2SO4,
①D的化学式是 ;
②某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应化学方程式是: .

(1)若试剂a是NaOH溶液,
①C的名称是
②B与试剂a反应的离子方程式是
(2)若试剂b是稀H2SO4,
①D的化学式是
②某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应化学方程式是:
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:元素X、Y的单质是生活中常见的金属,结合反应条件和转化关系,A、B是氧化物,则X为Al,Y为Fe,Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,则试剂a为NaOH溶液时,C为偏铝酸钠;试剂b为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂a为硫酸时,C为硫酸铝,该溶液水解显酸性,最后结合化学用语来解答即可.
解答:
解:元素X、Y的单质是生活中常见的金属,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,则试剂a为NaOH溶液时,C为偏铝酸钠;试剂b为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂a为硫酸时,C为硫酸铝,该溶液水解显酸性,
(1)若试剂a是NaOH溶液,
①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:偏铝酸钠;
②分析判断B为Al2O3,与试剂a为NaOH反应的离子方程式是:Al2O3+2OH-═2AlO2-+-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+-+H2O;
(2)若试剂b是稀硫酸,
①依据上述飞可知,D为硫酸铁,
故答案为:Fe2(SO4)3;
②E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
(1)若试剂a是NaOH溶液,
①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:偏铝酸钠;
②分析判断B为Al2O3,与试剂a为NaOH反应的离子方程式是:Al2O3+2OH-═2AlO2-+-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+-+H2O;
(2)若试剂b是稀硫酸,
①依据上述飞可知,D为硫酸铁,
故答案为:Fe2(SO4)3;
②E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
点评:本题考查无机物的推断,明确铝热反应及Al、氧化铝、Fe、氧化铁的性质即可解答,并注意试剂a可以为酸或强碱来分析解答,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
工业上用含FeSO4为50%的绿矾来生产复印机墨粉原料Fe3O4,将该绿矾溶解除杂后,加入足量的NaOH溶液后并通入适量空气(在标准状况下反应,空气中O2占20% ),最终得到Fe3O4,其最终反应的化学方程式为:
Fe(OH)2+2Fe(OH)3=Fe3O4?4H2O.在生产过程中,若绿矾的投料速率是9.12kg/h,为了得到较纯产品,则鼓入空气的速率为( )
Fe(OH)2+2Fe(OH)3=Fe3O4?4H2O.在生产过程中,若绿矾的投料速率是9.12kg/h,为了得到较纯产品,则鼓入空气的速率为( )
| A、112L/h |
| B、224 L/h |
| C、448 L/h |
| D、560L/h |
用NA表示阿伏加德罗常数,32g O2含有的氧原子数为( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
已知,常温下某浓度NaHSO3稀溶液的pH<7.则该稀溶液中下列粒子关系正确的是( )
| A、c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
| B、c(Na+)>c(HSO3-)+c(SO32-) |
| C、c(Na+)+c(H+)=2c(SO32-) |
| D、c(Na+)+c(H+)=c(HSO3-)+c(OH-) |
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A、22.4L的CO气体和1mol N2所含的电子数相等 |
| B、1L密度为1.84g?cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA |
| C、在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA |
| D、1mol/L FeCl3 溶液中,含有Cl-的数目为3NA |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、标准状况下,11.2L乙醇所含的羟基数为0.5NA |
| B、电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.6NA |
| C、1mol Cu与足量的硫固体反应转移的电子数为2NA |
| D、标准状况下,30g NO和16g O2混合所生成的气体分子数为NA |
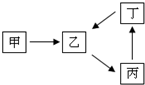 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.