题目内容
 2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!(1)KMnO4、双氧水、活性炭常用于饮用水的处理,但三者在联合使用时必须有先后顺序.
①氧化反应:H2O2-2eˉ→2H++O2↑
还原反应:MnO4ˉ+5eˉ+8H+→Mn2++4H2O
写出该反应的化学方程式
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投放,否则会发生KMnO4+C+H2O→MnO2+X+K2CO3(未配平),其中X的化学式为
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关想象如图1所示:
请根据图1、2回答下列问题:
①溶液中一定存在的阳离子是
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为
③试确定NO3-是否存在?
考点:无机物的推断,离子方程式的书写,氧化还原反应
专题:氧化还原反应专题,离子反应专题
分析:(1)①酸性条件下KMnO4与H2O2发生氧化还原反应生成O2和Mn2+;
②C被氧化为+4价化合物,结合质量守恒、得失电子守恒配平方程式可确定X;
(2)根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③和图2确定有Al3+和Mg2+,生成白色沉淀,则不含Fe3+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、Mg2+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(Fe2+),再根据电荷守恒确定有没有NO3-.
②C被氧化为+4价化合物,结合质量守恒、得失电子守恒配平方程式可确定X;
(2)根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③和图2确定有Al3+和Mg2+,生成白色沉淀,则不含Fe3+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、Mg2+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(Fe2+),再根据电荷守恒确定有没有NO3-.
解答:
解:(1)①由氧化反应和含有反应可知酸性条件下KMnO4与H2O2发生氧化还原反应生成O2和Mn2+,结合电子守恒可知反应的化学方程式为5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O,
故答案为:5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O;
②已知KMnO4+C+H2O→MnO2+X+K2CO3,反应中Mn元素化合价由+7价降低到+4价,C元素化合价由0价升高到+4价,则有4KMnO4+3C+H2O→4MnO2+X+K2CO3,由质量守恒可知X应含有C、K、H、O等元素,应为KHCO3,
故答案为:KHCO3;
(2)①由图2可知,A→B段发生反应为Al(OH)3 +OH-=AlO2-+2H2O,消耗n(NaOH)=0.005mol,则n(Al3+)=n(Al(OH)3)=0.005mol,
O→A段发生:Al(OH)3 +OH-=AlO2-+2H2O,Mg2++2OH-=Mg(OH)2↓,则生成沉淀消耗NaOH的物质的量为3n(Al3+)+2n(Mg2+)=0.035mol,
则n(Mg2+)=
=0.001mol,
故答案为:Al3+、Mg2+; Al3+ 0.005 mo1、Mg2+0.001 mo1;
②实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O,答案为:Al(OH)3+OH-=AlO2-+2H2O;
③已知硫酸钡沉淀为2.33g,则n(SO42-)=
=0.01mol,
n(Al3+)=0.005mol,n(Mg2+)=0.01mol 所以溶液中Mg2+和Al3+所带正电荷与SO42-所带负电荷不相等,因此存在NO3-,
设NO3-物质的量为nmol,
根据电荷守恒得:3n(Al3+)+2n(Mg2+)=2n(SO42-)+n(NO3-),
所以n(NO3-)=0.015mol,
所以c(NO3-)═
=0.15mol/L,
故答案为:存在; 0.15 mo1/L.
故答案为:5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O;
②已知KMnO4+C+H2O→MnO2+X+K2CO3,反应中Mn元素化合价由+7价降低到+4价,C元素化合价由0价升高到+4价,则有4KMnO4+3C+H2O→4MnO2+X+K2CO3,由质量守恒可知X应含有C、K、H、O等元素,应为KHCO3,
故答案为:KHCO3;
(2)①由图2可知,A→B段发生反应为Al(OH)3 +OH-=AlO2-+2H2O,消耗n(NaOH)=0.005mol,则n(Al3+)=n(Al(OH)3)=0.005mol,
O→A段发生:Al(OH)3 +OH-=AlO2-+2H2O,Mg2++2OH-=Mg(OH)2↓,则生成沉淀消耗NaOH的物质的量为3n(Al3+)+2n(Mg2+)=0.035mol,
则n(Mg2+)=
| 0.035mol-3×0.005mol |
| 2 |
故答案为:Al3+、Mg2+; Al3+ 0.005 mo1、Mg2+0.001 mo1;
②实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O,答案为:Al(OH)3+OH-=AlO2-+2H2O;
③已知硫酸钡沉淀为2.33g,则n(SO42-)=
| 2.33g |
| 233g/mol |
n(Al3+)=0.005mol,n(Mg2+)=0.01mol 所以溶液中Mg2+和Al3+所带正电荷与SO42-所带负电荷不相等,因此存在NO3-,
设NO3-物质的量为nmol,
根据电荷守恒得:3n(Al3+)+2n(Mg2+)=2n(SO42-)+n(NO3-),
所以n(NO3-)=0.015mol,
所以c(NO3-)═
| 0.015mol |
| 0.1L |
故答案为:存在; 0.15 mo1/L.
点评:本题考查较为综合,涉及氧化还原反应以及离子的检验和计算能问题,侧重于学生的分析能力和计算能力的考查,注意把握题给信息,结合离子方程式计算该题,难度中等.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
下列离子方程式书写正确的是( )
A、碳酸氢钠溶液呈碱性:HCO
| ||||
| B、FeS固体放入稀硝酸中:FeS+2H+=Fe2++H2S↑ | ||||
C、用饱和碳酸钠溶液多次浸取BaSO4固体:BaSO4+CO
| ||||
D、向KHCO3溶液中滴入少量的Ba(OH)2溶液:HC
|
不能用离子方程式 CO32-+2H+═CO2↑+H2O表示的反应是( )
| A、K2CO3+2HNO3═2KNO3+CO2↑+H2O |
| B、Na2CO3+2HCl═2NaCl+CO2↑+H2O |
| C、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| D、(NH4)2CO3+H2SO4═(NH4)2SO4+CO2↑+H2O |
 用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )| A、常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
| B、23g钠与一定量的氧气作用,若两者均无剩余,转移NA个电子 |
| C、1mol/L (NH4)2SO4溶液中,含SO42-NA个,NH4+少于2NA个 |
| D、0.5mol雄黄(As4S4,结构如图)含有NA个S-S键 |

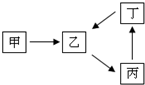 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.