题目内容
下列离子在溶液中不能大量共存的是( )
A、K+、MnO
| ||
B、OH-、AlO
| ||
C、AlO
| ||
D、K+、SO
|
考点:离子共存问题
专题:离子反应专题
分析:离子之间满足离子反应发生的体积(生成沉淀、气体、弱电解质、发生氧化还原反应等),在溶液中不能够大量共存,若不满足离子反应发生条件,在溶液中就能够大量共存,据此完成本题.
解答:
解:A、该组离子之间不发生反应,能够大量共存,故A不选;
B、OH-、AlO2-、Na+、Cl-离子之间不满足离子反应发生条件,在溶液中能够大量共存,故B不选;
C、偏铝酸根离子能够与氢离子反应,在溶液中不能够大量共存,故C选;
D、各离子之间不发生反应,在溶液中能够大量共存,故D不选;
故选C.
B、OH-、AlO2-、Na+、Cl-离子之间不满足离子反应发生条件,在溶液中能够大量共存,故B不选;
C、偏铝酸根离子能够与氢离子反应,在溶液中不能够大量共存,故C选;
D、各离子之间不发生反应,在溶液中能够大量共存,故D不选;
故选C.
点评:本题考查离子共存的正误判断,该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A、22.4 L CO2与CO的混合气体中含碳原子数为NA |
| B、常温下,1L 0.1 mol?L-1的NH4NO3溶液中氮原子数为0.2 NA |
| C、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
| D、在铁参与的反应中,5.6 g铁完全反应失去的电子数一定为0.3 NA |
工业上用含FeSO4为50%的绿矾来生产复印机墨粉原料Fe3O4,将该绿矾溶解除杂后,加入足量的NaOH溶液后并通入适量空气(在标准状况下反应,空气中O2占20% ),最终得到Fe3O4,其最终反应的化学方程式为:
Fe(OH)2+2Fe(OH)3=Fe3O4?4H2O.在生产过程中,若绿矾的投料速率是9.12kg/h,为了得到较纯产品,则鼓入空气的速率为( )
Fe(OH)2+2Fe(OH)3=Fe3O4?4H2O.在生产过程中,若绿矾的投料速率是9.12kg/h,为了得到较纯产品,则鼓入空气的速率为( )
| A、112L/h |
| B、224 L/h |
| C、448 L/h |
| D、560L/h |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Fe3+、Ba2+、OH-、NO3- |
| B、Ba2+、Na+、SO42-、0H- |
| C、K+、Al3+、NO3-、Cl- |
| D、H+、K+、CO32-、SO42- |
不能用离子方程式 CO32-+2H+═CO2↑+H2O表示的反应是( )
| A、K2CO3+2HNO3═2KNO3+CO2↑+H2O |
| B、Na2CO3+2HCl═2NaCl+CO2↑+H2O |
| C、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| D、(NH4)2CO3+H2SO4═(NH4)2SO4+CO2↑+H2O |
用NA表示阿伏加德罗常数,32g O2含有的氧原子数为( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A、22.4L的CO气体和1mol N2所含的电子数相等 |
| B、1L密度为1.84g?cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA |
| C、在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA |
| D、1mol/L FeCl3 溶液中,含有Cl-的数目为3NA |
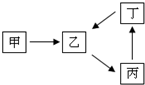 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.