题目内容
已知A~L分别代表一种物质,它们均由周期表前20号中的元素组成,图中部分反应条件和产物已经略去.
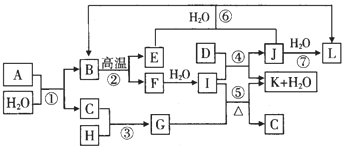
已知C、D、E、H是常见的气体,D为单质.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法,反应⑥是J物质在空气中失效的反应原理.
请回答下列问题:
(1)生产D的工业被称为 .
(2)反应②的化学方程式为 .
(3)反应⑥在溶液中发生反应的离子方程式为 .
(4)反应③常用于检验C或H的反应现象是 .实验室用38%(密度为1.19g/cm3)的H溶液配制一定质量2%的H溶液,所需要的玻璃仪器有 .
(5)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为 .
已知C、D、E、H是常见的气体,D为单质.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法,反应⑥是J物质在空气中失效的反应原理.

请回答下列问题:
(1)生产D的工业被称为
(2)反应②的化学方程式为
(3)反应⑥在溶液中发生反应的离子方程式为
(4)反应③常用于检验C或H的反应现象是
(5)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
考点:无机物的推断
专题:推断题
分析:图中各物质是由1~20号元素中部分元素组成的单质或其化合物,反应⑥是J物质在空气中失效的反应原理,说明J为漂白粉的主要成分为Ca(ClO)2,E为CO2,反应④是化工生产中的重要反应,应是工业制备漂白粉原理,F与水反应生成Ca(OH)2,则F为CaO,反应②是化工生产中的重要反应,为碳酸钙高温分解反应,故B为CaCO3、E为CO2.则I为Ca(OH)2、J为Ca(ClO)2、K为CaCl2,E为CO2,L为HClO;刺激性气味的气体,反应⑤是实验室制备气体C,结合反应物与生成可知,为制备氨气的反应,故C为NH3、G为NH4Cl,结合转化关系可知H为HCl.物质A由三种元素组成,1molA与水反应可生成1molB(CaCO3)和2molC(NH3),根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,据此解答.
解答:
解:图中各物质是由1~20号元素中部分元素组成的单质或其化合物,反应④是化工生产中的重要反应,反应⑥是J物质在空气中失效的反应原理,说明J为漂白粉的主要成分为Ca(ClO)2,E为CO2,应是工业制备漂白粉原理,F与水反应生成Ca(OH)2,则F为CaO,Dw为Cl2;反应②是化工生产中的重要反应,为碳酸钙高温分解反应,故B为CaCO3、E为CO2.则I为Ca(OH)2、J为Ca(ClO)2、K为CaCl2,E为CO2,C是无色有刺激性气味的气体,反应⑤是实验室制备气体C,结合反应物与生成可知,为制备氨气的反应,故C为NH3、G为NH4Cl,结合转化关系可知H为HCl.物质A由三种元素组成,1molA与水反应可生成1molB(CaCO3)和2molC(NH3),根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2;
(1)生产D为Cl2的工业是惰性电极电解饱和氯化钠溶液,被称为氯碱工业,故答案为:氯碱工业;
(2)反应②是化工生产中的重要反应,为碳酸钙高温分解反应,反应②的化学方程式为:CaCO3
CaO+CO2↑,故答案为:CaCO3
CaO+CO2↑;
(3)反应⑥为次氯酸钙和二氧化碳、水反应生成碳酸钙沉淀和次氯酸的反应,反应的离子方程式为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO;
(4)反应③常用于检验C为NH3,H为HCl反应的现象为有大量白烟生成.实验室用38%(密度为1.19g/cm3)的H为HCL液配制一定质量2%的H溶液,所需要的玻璃仪器有烧杯、玻璃棒、量筒,
故答案为:有大量白烟生成;烧杯、玻璃棒、量筒;
(5)物质A由三种元素组成,1molA与水反应可生成1molCaCO3和2molNH3,根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,;
故答案为:CaCN2.
(1)生产D为Cl2的工业是惰性电极电解饱和氯化钠溶液,被称为氯碱工业,故答案为:氯碱工业;
(2)反应②是化工生产中的重要反应,为碳酸钙高温分解反应,反应②的化学方程式为:CaCO3
| ||
| ||
(3)反应⑥为次氯酸钙和二氧化碳、水反应生成碳酸钙沉淀和次氯酸的反应,反应的离子方程式为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO;
(4)反应③常用于检验C为NH3,H为HCl反应的现象为有大量白烟生成.实验室用38%(密度为1.19g/cm3)的H为HCL液配制一定质量2%的H溶液,所需要的玻璃仪器有烧杯、玻璃棒、量筒,
故答案为:有大量白烟生成;烧杯、玻璃棒、量筒;
(5)物质A由三种元素组成,1molA与水反应可生成1molCaCO3和2molNH3,根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,;
故答案为:CaCN2.
点评:本题考查无机物的推断,物质转化关系分析判断,反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法,反应⑥是J物质在空气中失效的反应原理是突破口,结合J的用途与中学常见的重要化工反应进行推断,侧重学生对元素化合物知识的熟练掌握考查,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组中的离子,能在溶液中大量共存的是( )
| A、Fe3+、Ba2+、OH-、NO3- |
| B、Ba2+、Na+、SO42-、0H- |
| C、K+、Al3+、NO3-、Cl- |
| D、H+、K+、CO32-、SO42- |
用NA表示阿伏加德罗常数,32g O2含有的氧原子数为( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
已知,常温下某浓度NaHSO3稀溶液的pH<7.则该稀溶液中下列粒子关系正确的是( )
| A、c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
| B、c(Na+)>c(HSO3-)+c(SO32-) |
| C、c(Na+)+c(H+)=2c(SO32-) |
| D、c(Na+)+c(H+)=c(HSO3-)+c(OH-) |
下列离子方程式表达正确的( )
| A、硫化钠的水解反应:S2-+2H2O?H2S+2OH- |
| B、铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2 |
| C、在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+═4Fe3++2OH- |
| D、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
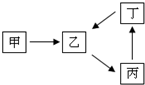 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.