题目内容
9. 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
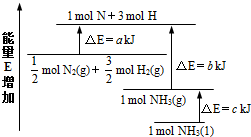
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.
(2)若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是391.55kJ/mol.
分析 (1)根据反应热等于旧键断裂吸收的能量减去新键形成所放出的能量计算反应热并书写热化学方程式,同时注意反应物的物质的量和生成物的聚集状态;
(2)根据断裂旧键要吸热,形成新键要放热,反应热等于反应物的总键能减去生成物的总键能计算.
解答 解:(1)解:由图可以看出,断裂$\frac{1}{2}$molN2(g)和$\frac{3}{2}$molH2(g)的吸收能量为akJ,形成1molNH3(g)的所放出的能量为bkJ,
所以,$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)?NH3(g)△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)?NH3(l)△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1;
(2)N2和H2合成NH3的方程式为:N2+3H2?2NH3,由N2和H2合成1molNH3时可放出46.2kJ/mol的热量,则反应的△H=-2×46.2=-92.4kJ/mol,
1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×948.9kJ•mol-1+3×436.0kJ•mol-1=2256.9kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则2256.9-6×x=-92.4kJ/mol,解得x=391.55kJ/mol,
故答案为:391.55.
点评 本题考查了热化学方程式的书写方法,盖斯定律的计算应用,反应热等于反应物的总键能减去生成物的总键能计算,题目难度中等.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案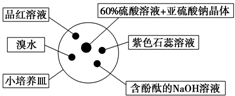 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变蓝色 | B. | 品红溶液褪色 | ||
| C. | 溴水橙色褪去 | D. | 含酚酞的NaOH溶液红色变浅或褪色 |
| A. | O、S、Na、K的原子半径一次增大 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | HF、HCl、HBr、HI的沸点依次增高 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
 ,形成过程
,形成过程 ;
;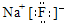 ,形成过程
,形成过程 ;
; ,形成过程
,形成过程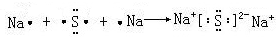 ;
; ;
; ,形成过程
,形成过程 .
. ,则A的可能结构式为
,则A的可能结构式为 、CH3CH2CHO;
、CH3CH2CHO;