题目内容
17.某温度下在容积不变的密闭容器中发生如下反应:2SO2+O2?2SO3(g),若开始时只充入2molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2mol SO2和1molO2的混合气体,达到平衡时SO2的转化率为( )| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
分析 在相同的温度下,按化学计量转化到一边,对应成分的物质的量相同,平衡时各成分的百分含量相同,两平衡是等效平衡;
据此计算从SO3开始进行反应,达相同的平衡状态,混合气体的压强比起始时增大了20%,计算平衡时SO2的物质的量;
根据从SO2和O2起始达平衡时,据此计算平衡时消耗n(SO2),得到二氧化硫的转化率.
解答 解:在相同的温度下,按化学计量转化到一边,根据方程式2SO2(g)+O2(g)?2SO3(g)可知,2molSO2和1molO2完全转化,可得n(SO3)=n(SO2)=2mol,故从SO3开始进行反应,达相同的平衡状态,需要SO3的物质的量为2mol,对应成分的物质的量相同,所以说明两平衡是等效平衡;
若开始时只充入2mol SO3,达到平衡时,混合气体的压强比起始时增大了20%,设生成二氧化硫物质的量x,
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) 0 0 2
变化量(mol) x 0.5x x
平衡量(mol) x 0.5x 2-x
压强之比等于气体物质的量之比,x+0.5x+2-x=2+2×20%,
解得:x=0.8mol;
若开始时只充入了2mol SO2和1mol O2的混合气体,达到平衡状态消耗二氧化硫物质的量=2mol-0.8mol=1.2mol,
所以达到平衡时SO2的转化率为:$\frac{1.2mol}{2mol}$×100%=60%,
故选C.
点评 本题考查了化学平衡的计算应用,题目难度中等,明确等效平衡的判断方法为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
7.氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化.实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如下:

实验步骤:
①检验装置气密性;②开始通入H2;③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;⑤向三颈瓶中滴入20mLCCl4;⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)A装置的作用是A装置的作用是使氢气和四氯化碳蒸汽充分混合.
(2)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为_加热时氢气遇氧气发生爆炸(或生成的氯仿被氧气氧化).
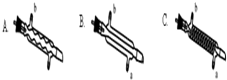
(3)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
(4)C处中应选用的冷凝管为B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(5)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式2CHCl3+O2=2COCl2+2HCl.
(7)该实验中,氯仿的产率为61%.

| 物质 | 相对分子质量 | 密度(g/mL) | 沸点(℃) | 水中 溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
①检验装置气密性;②开始通入H2;③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;⑤向三颈瓶中滴入20mLCCl4;⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)A装置的作用是A装置的作用是使氢气和四氯化碳蒸汽充分混合.
(2)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为_加热时氢气遇氧气发生爆炸(或生成的氯仿被氧气氧化).

(3)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
(4)C处中应选用的冷凝管为B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(5)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式2CHCl3+O2=2COCl2+2HCl.
(7)该实验中,氯仿的产率为61%.
8.既属于有机物,又属于酸的是( )
| A. | H2SO4 | B. | CH2=CH2 | C. | CH3COOH | D. | CH3CH2OH |
5.广州亚运会火炬“潮流”所用燃料的主要成分是丙烷,下列说法不正确的是( )
| A. | 分子中的所有碳原子不在同一条直线上 | |
| B. | 在光照条件下,可与Cl2发生取代反应 | |
| C. | 丙烷的沸点比丁烷的沸点高,更易液化 | |
| D. | 丙烷难溶于水,且密度小于水 |
12.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与水以任意比例互溶 | |
| C. | 10mL 1mol/L的甲酸溶液恰好与10mL 1mol/L的NaOH溶液完全反应 | |
| D. | 在相同温度下,物质的量浓度相同的甲酸导电性比硫酸弱 |
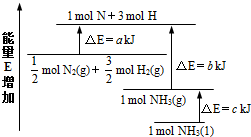 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.