题目内容
4.常利用Na2S2O3与硫酸反应研究条件对化学反应速率的影响.①写出二者反应的离子方程式:S2O32-+2H++SO42-═SO42-+S↓+SO2+H2O
②下列说法正确的是b
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响.
分析 ①Na2S2O3与硫酸反应生成硫、二氧化硫等;
②硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,反应速率越快,出现浑浊时间越短.
解答 解:①Na2S2O3与硫酸反应生成硫、二氧化硫,反应的离子方程式为S2O32-+2H++SO42-═SO42-+S↓+SO2+H2O,故答案为:S2O32-+2H++SO42-═SO42-+S↓+SO2+H2O;
②反应速率为单位时间内浓度的变化,固体浓度基本不变,一般不用于计算反应速率,根据硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,
故答案为:b.
点评 本题考查了探究影响化学反应速率的因素,为高频考点,题目难度中等,注意掌握化学反应速率的影响因素,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
14.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:CH3OCH3>CH3CH2OH | D. | 热稳定性:HF>H2O>NH3 |
12.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与水以任意比例互溶 | |
| C. | 10mL 1mol/L的甲酸溶液恰好与10mL 1mol/L的NaOH溶液完全反应 | |
| D. | 在相同温度下,物质的量浓度相同的甲酸导电性比硫酸弱 |
19.在0.1mol•L-1NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 降低温度,溶液中c(NH4+)增大 | |
| B. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ 增大 | |
| C. | 加入水时,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向逆反应方向移动,溶液中c(OH-)减小 |
16.0.1mol•L-1的盐酸溶液与0.1mol•L-1的氨水等体积混合,溶液中离子浓度关系正确的是( )
| A. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
13.密闭容器中有反应:Mg+2HCl=MgCl2+H2↑ 2s后HCl的浓度由2mol/L减小到1mol/L,求该反应的速率( )
| A. | 1mol/(L•s) | B. | 0.5mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 无法计算 |
14.某饱和一元醇和一元醛的混合物共3g,和足量银氨溶液反应后,还原出16.2g银.下列说法正确的是( )
| A. | 该一元醇也能与银氨溶液反应生成银 | |
| B. | 混合物中一定含有甲醛 | |
| C. | 混合物中醇与醛的物质的量之比为1:3 | |
| D. | 混合物中的一元醛是乙醛 |
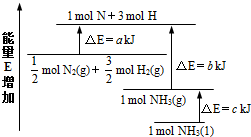 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.