题目内容
1.25℃时,pH=3的盐酸溶液中由水电离出的c(H+)是pH=5的盐酸中由水离出的c(H-)10-2倍.分析 盐酸抑制水的电离,pH=3的盐酸,c(H+)=10-3mol/L,pH=5的盐酸溶液中c(H+)=10-5mol/L,溶液中OH-全部由水电离产生,水电离出的c(H+)=c(OH-),以此解答.
解答 解:水的电离方程式为:H2O?H++OH-,25℃时kw=c(H+)×c(OH-)═1×10-14,pH=3的盐酸,c(H+)=10-3mol/L,由水电离生成的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,pH=5的盐酸,c(H+)=10-5mol/L,由水电离生成的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,
因此由水电离出的c(H+)之比为:10-11mol/L:10-9mol/L=10-2,
故答案为:10-2.
点评 本题考查了水的电离,为高频考点,侧重于学生的分析能力和计算能力的考查,可以根据常温下水的离子积计算出水电离氢离子浓度,关键是准确判断酸溶液和碱溶液中水的电离情况,难度不大.

练习册系列答案
相关题目
11.下列说法中,正确的是( )
| A. | 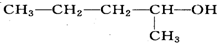 的名称是1-甲基-1-丁醇 的名称是1-甲基-1-丁醇 | |
| B. | 食醋中含有乙酸,乙酸可由乙醇或乙醛氧化得到 | |
| C. | 1mol 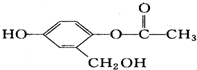 最多能与4molNaOH溶液反应 最多能与4molNaOH溶液反应 | |
| D. | 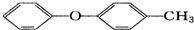 的同分异构体中有醇、酚、脂等类别 的同分异构体中有醇、酚、脂等类别 |
12.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与水以任意比例互溶 | |
| C. | 10mL 1mol/L的甲酸溶液恰好与10mL 1mol/L的NaOH溶液完全反应 | |
| D. | 在相同温度下,物质的量浓度相同的甲酸导电性比硫酸弱 |
16.0.1mol•L-1的盐酸溶液与0.1mol•L-1的氨水等体积混合,溶液中离子浓度关系正确的是( )
| A. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
13.密闭容器中有反应:Mg+2HCl=MgCl2+H2↑ 2s后HCl的浓度由2mol/L减小到1mol/L,求该反应的速率( )
| A. | 1mol/(L•s) | B. | 0.5mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 无法计算 |
10.用惰性电极电解下列溶液时在阴阳两极收集到的气体体积比为2:1的是( )
| A. | H2SO4 | B. | HCl | C. | AgNO3 | D. | NaOH |
11.常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性,下列各项可能正确的是( )
| A. | 混合前pH(CH3COOH)+pH(NaOH)=14 | B. | 混合后c(Na+)=c(CH3COO3-)+c(OH-) | ||
| C. | 混合前c(CH3COOH)>c(NaOH) | D. | 混合后c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
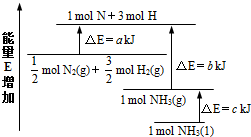 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.