题目内容
15.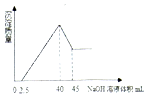 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 4mol/L |
分析 由图象可知,向滤液中加入2.5mL10mol/L的NaOH溶液,没有沉淀生成,说明硫酸有剩余,继续加入NaOH溶液,当加入氢氧化钠共40mL时,沉淀量最大,此时溶液溶质为硫酸钠,根据钠元素、硫酸根守恒有2n(H2SO4)=2n(Na2SO4)=n(NaOH),再根据c=$\frac{n}{V}$计算原H2SO4物质的量浓度.
解答 解:当加入氢氧化钠共40mL时,沉淀量最大,此时溶液溶质为硫酸钠,根据钠元素、硫酸根守恒有2n(H2SO4)=2n(Na2SO4)=n(NaOH)=0.04L×10mol/L=0.4mol,所以n(H2SO4)=0.2mol,故原H2SO4物质的量浓度为$\frac{0.2mol}{0.2L}$=1mol/L.
故选A.
点评 本题考查混合物反应的计算,涉及方程式的计算、混合物的计算、图象分析等知识,题目难度中等,明确图象各段发生的反应是解题的关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
5.下列有关非金属元素及其化合物说法正确的是( )
| A. | 非金属元素的单质可以置换出非金属单质,但不能置换出金属单质 | |
| B. | Na2CO3和SiO2加热生成CO2,说明H2SiO3的酸性比H2CO3的强 | |
| C. | 液氨不能导电,所以液氨是非电解质,氨水能够导电,所以氨水是电解质 | |
| D. | S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
3.将Na、Al、Al2O3三种物质的混合物加入水中,完全反应后,所得溶液中只含有NaAlO2一种溶质,则Na、Al、Al2O3的物质的量之比可能是( )
| A. | 1:1:2 | B. | 1:4:1 | C. | 4:4:1 | D. | 4:2:1 |
20.下列实验方法能达到实验目的是( )
| A. | 用KMnO4溶液鉴别甲烷和乙烯 | |
| B. | 用焰色反应鉴别KNO3和KCl | |
| C. | 用BaCl2溶液鉴别Na2CO3和Na2SO4 | |
| D. | 用NaOH溶液除去Cl2中含有的少量HCl |
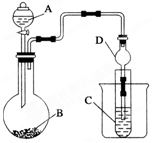 为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置:
为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置:
 .
.