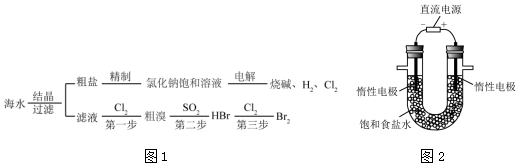
题目内容
17.下列有关叙述不正确的是( )①在100℃,101KPa条件下,液态水气化热为40.69kJ•mol-1,则H2O(g)=H2O(l)△H=+40.69KJ•mol-1
②已知25℃时,MgCO3的Ksp=6.82×10-6,则在该温度下,含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO32-)是否相等,总有c(Mg2+)•c(CO32-)=6.82×10-6
③电解NaNO3溶液时,随着电解进行,溶液的pH减小
④常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,则NH3•H2O电离被抑制,溶液pH减少.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
分析 ①从不同状态的物质之间的转化判断,一般来说,气体转化为液体、液体转化为固体为放热过程,反之吸热;
②碳酸镁的溶度积只受温度的影响,温度不变,则其溶度积不变;
③电解硝酸钠溶液的实质为电解水,溶液的pH不变;
④NH3•H2O溶液中加入少量NH4Cl晶体,平衡向逆方向移动,电离程度降低.
解答 解:①气体转化为液体是放热过程,焓变为负值,正确的转化关系为:H2O(g)?H2O(l)△H=-40.69kJ•mol-1,故①错误;
②含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO32-)是否相等,温度不变其溶度积不变,则一定满足:Ksp(MgCO3)=c(Mg2+)•c(CO32-)=6.82×10-6,故②正确;
③电解NaNO3溶液时,阳极氢离子放电生成氢气,阴极氢氧根离子失去电子生成氧气,实质为电解水,则随着电解进行,溶液的pH不变,故③错误;
④NH3•H2O溶液中存在电离平衡,加入少量NH4Cl晶体,NH4+浓度增大使电离平衡向逆方向移动,电离程度降低,溶液的pH减小,故④正确;
故选D.
点评 本题考查较为综合,涉及反应热与焓变的应用、弱电解质的电离平衡、难溶物溶解平衡、电解原理等知识,题目难度中等,明确化学反应与能量变化的关系为解答关键,注意掌握弱电解质电离平衡及其影响、难溶物溶度积的影响因素,试题有利于提高学生的灵活应用能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
5.下列有关非金属元素及其化合物说法正确的是( )
| A. | 非金属元素的单质可以置换出非金属单质,但不能置换出金属单质 | |
| B. | Na2CO3和SiO2加热生成CO2,说明H2SiO3的酸性比H2CO3的强 | |
| C. | 液氨不能导电,所以液氨是非电解质,氨水能够导电,所以氨水是电解质 | |
| D. | S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
12.下列实验操作中,正确且能达到目的是( )
| A. |  图是除去水中泥沙 | B. |  图是配制0.100 mol/L稀硫酸 | ||
| C. |  图是点燃酒精灯 | D. |  图是检查装置的气密性 |