题目内容
14.下面为测定稀盐酸与稀NaOH溶液反应的中和热的实验.(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
分析 (1)该实验中氢氧化钠过量,若氯化氢部分挥发,会导致中和反应中放出的热量减小,测定结果偏低;
(2)先判断温度差的有效性,然后求出温度差平均值,然后根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(3)根据弱电解质电离吸收热量;
(4)没有用水洗涤温度计上的盐酸溶液,中和反应放热.
解答 解:(1)由于氢氧化钠过量,盐酸不足,若有部分氯化氢挥发,会导致生成水的物质的量减小,反应放出的热量减小,导致测定的中和热偏小;
故答案为:偏小;
(2)3次温度差分别为:6.6℃,6.7℃,6.8℃,数据均有效,温度差平均值为6.7℃,1.1mol•L-1的NaOH溶液50mL与1.0mol•L-1的盐酸50mL进行中和反应生成水的物质的量为0.05L×1.0mol=0.05mol,溶液的质量为100ml×1.00g•cm-3=100g,温度变化的值△T为6.7℃来计算,则生成0.05mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×6.7℃=2800.6J,即2.8006kJ,所以实验测得的中和热△H=-$\frac{2.8006kJ}{0.05mol}$=-56.0kJ/mol;
故答案为:-56.0kJ/mol;
(3)醋酸为弱酸,电离过程为吸热过程,所以用等浓度的醋酸与NaOH溶液反应,反应放出的热量偏低,测得的中和热的数值会偏低;
故答案为:偏小;醋酸为弱酸,电离过程为吸热过程;
(4)未用水洗涤温度计上的盐酸溶液,直接插到NaOH溶液中,因为会发生中和反应放热,所以△T偏大,但是△H为负,所以中和热偏小;
故答案为:偏小.
点评 本题考查中和热的测定,题目难度大,注意理解中和热测定原理以及测定反应热的误差等问题.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 漂白粉、Cl2、氨水、NaHCO3 | B. | 福尔马林、苯、Cu2(OH)2CO3、明矾 | ||
| C. | 盐酸、SO2、纯碱、NH4Cl | D. | 食醋、C2H5OH、苛性钾、NaHSO4 |
| A. | 2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ/mol | B. | 2H2(g)+O2(g)═2H2O(1)△H=+571.6 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol |
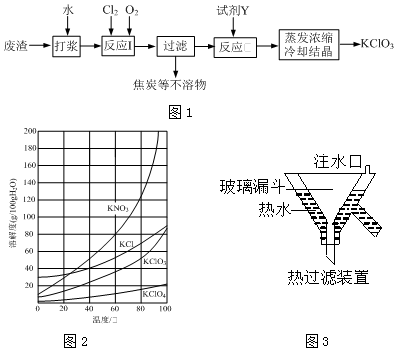
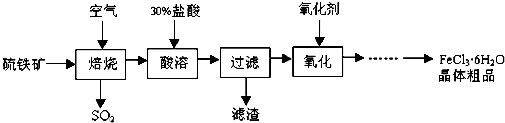
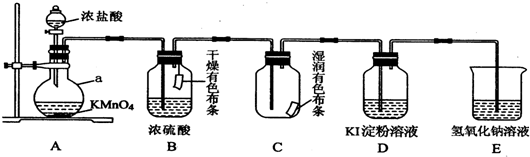
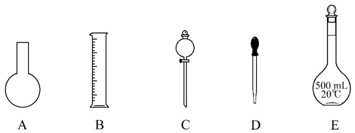
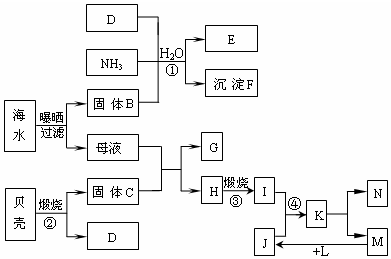
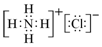 .
.