题目内容
9.下列四种有机化合物均含有多个官能团,其结构简式如下所示,下列有关说法中正确的是( )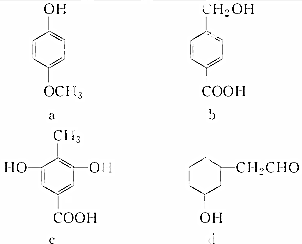
| A. | a属于酚类,可与NaHCO3溶液反应产生CO2 | |
| B. | b属于酚类,1 molb最多能与3 molH2发生加成反应 | |
| C. | 1 mol c最多能与3 mol Br2发生反应 | |
| D. | d属于醇类,可以发生消去反应 |
分析 A.a含酚-OH,与碳酸氢钠不反应;
B.b中-OH与苯环不直接相连,为醇,只有苯环与氢气发生加成反应;
C.只有酚-OH的邻位与溴水反应;
D.与-OH相连C的邻位C上有H.
解答 解:A.a含酚-OH,为酚类物质,但不能与碳酸氢钠反应,故A错误;
B.b中-OH与苯环不直接相连,为醇,只有苯环与氢气发生加成反应,则1 molb最多能与3 molH2发生加成反应,故B错误;
C.只有酚-OH的邻位与溴水反应,则1 mol c最多能与2 mol Br2发生反应,故C错误;
D.与-OH相连C的邻位C上有H,则该醇可发生消去反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、醇的区别及性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19. 下面是18×7的格子,按要求作答
下面是18×7的格子,按要求作答
(1)用封闭的实线绘出元素周期表的轮廓,注意:不得使用铅笔作图.
(2)C元素的一种中子数为10的同位素的原子符号为818O,C2-的离子结构示意图为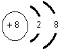 ,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )
,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )
(3)A、G、C中的2种或3种元素能形成18个电子的分子N2H4、H2O2(填化学式),其中A、G也能形成GA5的离子化合物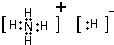 (填电子式).
(填电子式).
(4)请分别用1个离子方程式说明B和F的金属性强弱:Al3++3OH-=Al(OH)3↓或Al(OH)3+OH-=AlO2-+2H2O,C和D的非金属性强弱2F2+2H2O=4HF+O2.
(5)Fe位于周期表第四周期VIII族,请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱.写出总反应式:2 Fe3++Cu=2Fe2++Cu2+负极电极反应式:Cu-2e-=Cu2+,并在方框内画出实验装置图,并标注电极材料和电解质溶液.
 下面是18×7的格子,按要求作答
下面是18×7的格子,按要求作答| A | He | ||||||||||||||||
| G | C | D | |||||||||||||||
| B | E | F | I | H | |||||||||||||
| Fe | Cu | ||||||||||||||||
(2)C元素的一种中子数为10的同位素的原子符号为818O,C2-的离子结构示意图为
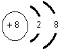 ,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )
,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )(3)A、G、C中的2种或3种元素能形成18个电子的分子N2H4、H2O2(填化学式),其中A、G也能形成GA5的离子化合物
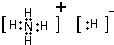 (填电子式).
(填电子式).(4)请分别用1个离子方程式说明B和F的金属性强弱:Al3++3OH-=Al(OH)3↓或Al(OH)3+OH-=AlO2-+2H2O,C和D的非金属性强弱2F2+2H2O=4HF+O2.
(5)Fe位于周期表第四周期VIII族,请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱.写出总反应式:2 Fe3++Cu=2Fe2++Cu2+负极电极反应式:Cu-2e-=Cu2+,并在方框内画出实验装置图,并标注电极材料和电解质溶液.
17.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:Br->Cl->F-
④稳定性:HCl>H2S>PH3.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:Br->Cl->F-
④稳定性:HCl>H2S>PH3.
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
14.下列说法错误的是( )
| A. | 11H、21H、31H、H+和H2是氢元素的五种不同粒子 | |
| B. | 白磷和红磷的相互转化属于物理变化 | |
| C. | 11H和21H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
18.下列说法正确的是( )
| A. | 邻二溴苯只有一种可以证明苯环结构中不存在单双键交替结构 | |
| B. | 可以用分液漏斗分离苯和硝基苯 | |
| C. | 制取一氯乙烷的最佳途径是通过乙烷与氯气反应获得 | |
| D. | 等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3:1 |
19.反应3H2+N2$?_{催化剂}^{高温,高压}$2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 升高温度能加快反应速率 | |
| B. | 使用恰当的催化剂能加快反应速率 | |
| C. | 增大N2的浓度能加快反应速率 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |

 .
. ,
,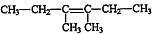 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$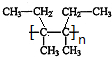 .
.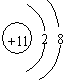 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键.