题目内容
17.下列各组中的性质比较,正确的是( )①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:Br->Cl->F-
④稳定性:HCl>H2S>PH3.
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
分析 ①非金属性越强,对应最高价氧化物的水化物酸性越强;
②金属性越强,对应最高价氧化物的水化物碱性越强;
③非金属性越强,对应阴离子还原性越弱;
④非金属性越强,对应氢化物越稳定.
解答 解:①非金属性越强,对应最高价氧化物的水化物酸性越强,则酸性:HClO4>HBrO4>HIO4,故正确;
②由同主族从上到下金属性增强,对应最高价氧化物的水化物碱性增强,则碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2,故正确;
③非金属性越强,对应阴离子还原性越弱,则还原性:Br->Cl->F-,故正确;
④非金属性越强,对应氢化物越稳定,则稳定性:HCl>H2S>PH3,故正确;
故选A.
点评 本题考查元素周期表及元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
7.已知反应:A(g)+2B(g)?C(s)+D(?)△H<0,将A和B按下图比例充入一体积为10L的密闭容器中,经20s达到平衡,A、B物质浓度的变化曲线如下图所示.下列说法正确的是( )
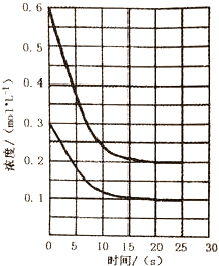

| A. | 从投料到20s时达到平衡,v(A)的反应速率为0.02mol•L-1•s-1 | |
| B. | 若该反应的化学平衡常数K=250,说明D的状态为气态 | |
| C. | 降低温度,有利于加快化学反应速率和提高反应的转化率 | |
| D. | 若D是固体且保持平衡的温度和压强不变,再向容器中充入3mol的B,则此时v正<v逆 |
8.三氯甲烷(CHCl3)又称氯仿,可用作麻醉剂,但在光照下易被氧化成剧毒的光气(COCl2).其反应式为2CHCl3+O2$\stackrel{光}{→}$2COCl2+2HCl,为了防止事故发生,在使用三氯甲烷前要先检验一下其是否变质,检验用的最佳试剂是( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | 溴水 | D. | 淀粉碘化钾溶液 |
5.反应4A(g)+5B(g)═4C(g)+4D(g)在0.5L密闭容器中进行,30s后A减少了0.90mol,则此反应的速率可表示为( )
| A. | v(A)=0.030 mol/(L•s) | B. | v(B)=0.075 mol/(L•s) | ||
| C. | v(C)=0.030 mol/(L•s) | D. | v(D)=0.030 mol/(L•s) |
2.下列措施肯定能使反应速率增大的是( )
| A. | 增大反应物的量 | B. | 增大压强 | C. | 适当升高温度 | D. | 使用催化剂 |
9.下列四种有机化合物均含有多个官能团,其结构简式如下所示,下列有关说法中正确的是( )
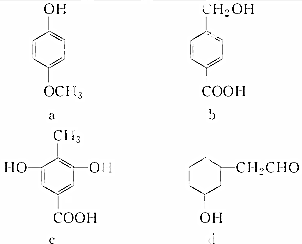

| A. | a属于酚类,可与NaHCO3溶液反应产生CO2 | |
| B. | b属于酚类,1 molb最多能与3 molH2发生加成反应 | |
| C. | 1 mol c最多能与3 mol Br2发生反应 | |
| D. | d属于醇类,可以发生消去反应 |
7.下列说法正确的是( )
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
 ;反应类型加聚反应.
;反应类型加聚反应.
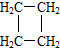 可简写成
可简写成 )
)
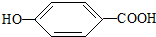 ),其反应方程式为:
),其反应方程式为: 、
、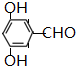 .
.