题目内容
19. 下面是18×7的格子,按要求作答
下面是18×7的格子,按要求作答| A | He | ||||||||||||||||
| G | C | D | |||||||||||||||
| B | E | F | I | H | |||||||||||||
| Fe | Cu | ||||||||||||||||
(2)C元素的一种中子数为10的同位素的原子符号为818O,C2-的离子结构示意图为
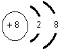 ,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )
,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )(3)A、G、C中的2种或3种元素能形成18个电子的分子N2H4、H2O2(填化学式),其中A、G也能形成GA5的离子化合物
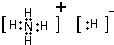 (填电子式).
(填电子式).(4)请分别用1个离子方程式说明B和F的金属性强弱:Al3++3OH-=Al(OH)3↓或Al(OH)3+OH-=AlO2-+2H2O,C和D的非金属性强弱2F2+2H2O=4HF+O2.
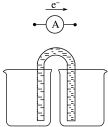
(5)Fe位于周期表第四周期VIII族,请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱.写出总反应式:2 Fe3++Cu=2Fe2++Cu2+负极电极反应式:Cu-2e-=Cu2+,并在方框内画出实验装置图,并标注电极材料和电解质溶液.
分析 根据元素在周期表中的位置知,A-I分别是H、Na、O、F、Mg、Al、N、Cl、Si元素,
(1)元素周期表的轮廓为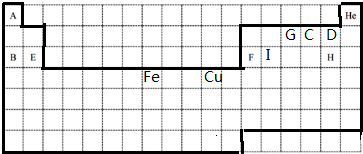 ;
;
(2)C是O元素,C元素的一种中子数为10的同位素,则该元素原子质量数为18;
C2-核内质子数是8、核外电子数是10;电子层结构相同的离子,离子半径随着原子序数增大而减小;
(3)A、G、C中的2种或3种元素能形成18个电子的分子有H2O2、N2H4;
其中A、G也能形成GA5的离子化合物,其阳离子是铵根离子、阴离子为H-;
(4)元素的金属性越强,其最高价氧化物的水化物碱性越强;
元素的非金属性越强,其单质的氧化性越强;
(5)Fe位于周期表第四周期第VIII族,
设计原电池实验,验证Cu2+、Fe3+氧化性的强弱,铁离子氧化性大铜离子,则反应方程式为2Fe3++Cu=2Fe2++Cu2+,失电子的金属作负极,不如Cu活泼的金属或导电的非金属作正极,如果设计的原电池含有盐桥,则电极材料与其对应的电解质具有相同元素.
解答 解:根据元素在周期表中的位置知,A-I分别是H、Na、O、F、Mg、Al、N、Cl、Si元素,
(1)元素周期表的轮廓为 ,
,
故答案为: ;
;
(2)C是O元素,C元素的一种中子数为10的同位素,则该元素原子质量数为18,该原子为818O;
C2-核内质子数是8、核外电子数是10,该离子结构示意图为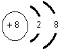 ;电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径从小到大顺序是Al3+<Mg2+<F-<O2-,
;电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径从小到大顺序是Al3+<Mg2+<F-<O2-,
故答案为:818O;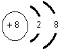 ;Al3+<Mg2+<F-<O2-;
;Al3+<Mg2+<F-<O2-;
(3)A、G、C中的2种或3种元素能形成18个电子的分子有H2O2、N2H4;
其中A、G也能形成GA5的离子化合物,其阳离子是铵根离子、阴离子为H-,该化合物电子式为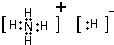 ,
,
故答案为:N2H4;H2O2;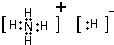 ;
;
(4)元素的金属性越强,其最高价氧化物的水化物碱性越强,离子方程式为Al3++3OH-=Al(OH)3↓或Al(OH)3+OH-=AlO2-+2H2O;
元素的非金属性越强,其单质的氧化性越强,该方程式为2F2+2H2O=4HF+O2,
故答案为:Al3++3OH-=Al(OH)3↓或Al(OH)3+OH-=AlO2-+2H2O;2F2+2H2O=4HF+O2;
(5)Fe位于周期表第四周期第VIII族,
设计原电池实验,验证Cu2+、Fe3+氧化性的强弱,铁离子氧化性大铜离子,则反应方程式为2Fe3++Cu=2Fe2++Cu2+,失电子的金属Cu作负极,不如Cu活泼的金属或导电的非金属作正极,如石墨,负极反应式为Cu-2e-=Cu2+,如果设计的原电池含有盐桥,则电极材料与其对应的电解质具有相同元素,设计的原电池为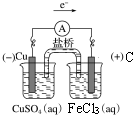 ,
,
故答案为:四周期;VIII族;2 Fe3++Cu=2Fe2++Cu2+;Cu-2e-=Cu2+; .
.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,涉及原电池设计、元素周期律、化学用语等知识点,明确元素周期表结构、元素周期律、基本原理等知识点是解本题关键,难点是原电池设计,题目难度不大.

 学业测评一课一测系列答案
学业测评一课一测系列答案| A. | 硫 | B. | 油渍 | C. | 石炭酸 | D. | 酚醛树脂 |
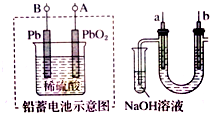
| A. | 铅蓄电池A极应与U形管中a极连接 | |
| B. | 铅蓄电池放电时溶液的pH值变小 | |
| C. | a电极用铁作电极,b电极用石墨作电极 | |
| D. | 实验结束后可将U型管、试管中的溶液倒入下水道 |
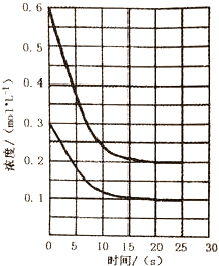
| A. | 从投料到20s时达到平衡,v(A)的反应速率为0.02mol•L-1•s-1 | |
| B. | 若该反应的化学平衡常数K=250,说明D的状态为气态 | |
| C. | 降低温度,有利于加快化学反应速率和提高反应的转化率 | |
| D. | 若D是固体且保持平衡的温度和压强不变,再向容器中充入3mol的B,则此时v正<v逆 |
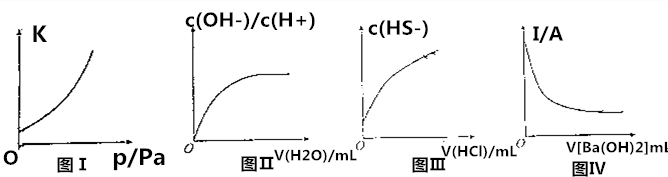
| A. | 图Ⅰ:其他条件不变,反应2NO2(g)?N2O4(g)的平衡常数与压强的关系 | |
| B. | 图Ⅱ:25℃时,稀释0.1mol•L-1CH3COOH溶液,$\frac{c(O{H}^{-})}{c({H}^{+})}$与加水的体积的关系 | |
| C. | 图Ⅲ:25℃时,向0.1mol•L-1Na2S溶液中滴加稀盐酸至足量,c(HS-)与盐酸体积的关系 | |
| D. | 图Ⅳ:一定温度下,稀硫酸的导电能力与加入的Ba(OH)2溶液体积的关系 |
| A. | SiO2和H2O | B. | SO2和Na2O2 | C. | NaCl和HCl | D. | AlCl3和KCl |
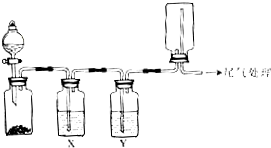 利用下图装置可以进行实验并能达到实验目的是( )
利用下图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | Na2SO3和盐酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 苯与浓溴水在铁催化下反应制溴苯并收集HBr | CCl4 | 浓硫酸 |
| D | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | 溴水 | D. | 淀粉碘化钾溶液 |
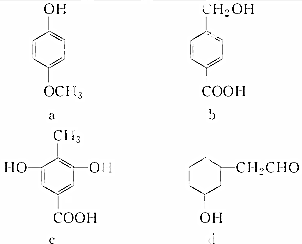
| A. | a属于酚类,可与NaHCO3溶液反应产生CO2 | |
| B. | b属于酚类,1 molb最多能与3 molH2发生加成反应 | |
| C. | 1 mol c最多能与3 mol Br2发生反应 | |
| D. | d属于醇类,可以发生消去反应 |