题目内容
11.25℃时,如果取0.1mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:(1)混合溶液的pH=8的原因(用离子方程式表示):A-+H2O?HA+OH-.
(2)混合溶液中由水电离出的c(H+)>(填“<”“>”或“=”)0.1mol•L-1 NaOH溶液中由水电离出的c(H+).
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH>7(填“<”“>”或“=”).
(4)将相同温度下相同浓度的五种溶液:①Na 2CO3 ②NH3•H2O ③NaCl ④NH4Cl ⑤CH3COOH
按pH由大到小的顺序排列②>①>③>④>⑤(填序号).
分析 (1)盐溶液呈碱性说明该盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
(2)含有弱根离子的盐能促进水电离,酸或碱能抑制水电离;
(3)根据题意知,HA的酸性比碳酸强,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,由此得知铵根离子水解程度小于碳酸根离子,所以(NH4)2CO3中溶液呈碱性;根据铵根离子的水解程度判断溶液酸碱性的大小,溶液浓度越稀,盐的水解程度越大;
(4)氯化铵属于强酸弱碱盐,水解显示酸性;碳酸钠属于强碱弱酸盐,水解显示碱性;氯化钠不水解;醋酸是弱酸,溶液显示酸性,氨水属于弱碱,显示碱性,其碱性强于碳酸钠中碳酸根离子水解的碱性.
解答 解:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol•L-1NaOH溶液中由水电离出的c(H+),
故答案为:>;
(3)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;故答案为:>;
(4)氯化铵属于强酸弱碱盐,水解显示酸性;碳酸钠属于强碱弱酸盐,水解显示碱性;氯化钠不水解;醋酸是弱酸,溶液显示酸性,氨水属于弱碱,显示碱性,其碱性强于碳酸钠中碳酸根离子水解的碱性,pH由大到小的顺序排列②>①>③>④>⑤,故答案为:②>①>③>④>⑤.
点评 本题考查了盐类的水解和弱电解质的电离等知识,注意强酸弱碱盐水解显示酸性、强碱弱酸盐显示碱性,强酸强碱盐显示中性,本题难度不大.

| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃(Na2SiO3溶液)可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2SiO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 因为NH3•H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
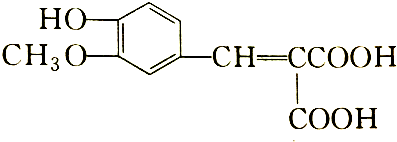 含有的官能团有( )
含有的官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 83 | B. | 81 | C. | 85 | D. | 56 |
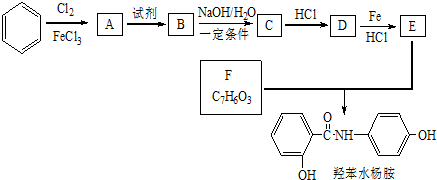
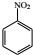 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
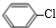 +HNO3$→_{△}^{浓H_{2}SO_{4}}$
+HNO3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.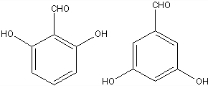 、
、 .
.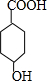 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$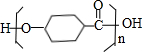 +(n-1)H2O.
+(n-1)H2O.