题目内容
6.开源节流是应对能源危机的重要举措.(1)下列做法有助于能源“开源节流”的是bcd(填字母).
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是c(填字母).
a.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
b.高温使水分解制氢:2H2O$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
d.天然气制氢:CH4+H2O$\stackrel{高温}{?}$CO+3H2
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4$\frac{\underline{\;>1000K\;}}{\;}$MnFe2O4-X+$\frac{X}{2}$
则第二步反应的化学方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑(条件不写).
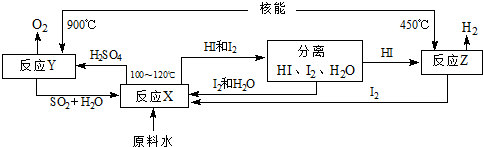
(4)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.反应X的化学方程式为SO2+I2+2H2O=2HI+H2SO4,该流程中循环使用的原料有SO2、I2.从理论上讲,该流程中,1mol原料水制得1molH2.
分析 (1)只要能减少自然资源的运用都属于“开源节流”;
(2)最节能的方法是运用太阳能;
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气;
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸;根据流程图判断能循环使用的物质;根据水和氢气的关系式计算生成的氢气的量.
解答 解:(1)只要能减少自然资源的运用都属于“开源节流”.
a、不能减少自然资源的运用,故错误.
b、c、d能减少自然资源的运用,故正确.
故答案为:bcd;
(2)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故答案为:C;
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑,故答案为:MnFe2O4-X+xH20=MnFe2O4+xH2↑;
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4;根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气,
故答案为:SO2+I2+2H2O=2HI+H2SO4;SO2、I2;1.
点评 本题考查较为综合,为高考常见题型和高频考点,题目涉及化学反应与能量、能源的综合利用等知识,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
10.下列物质不计入“空气污染指数”项目的是( )
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 二氧化氮 | D. | 可吸入颗粒 |
8.某酸二酯(CPPO)的组成如图所示
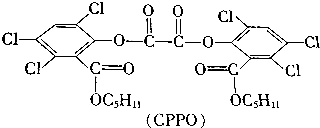
如果苯环上取代基位置和官能团位置都不改变,CPPO的结构有( )

如果苯环上取代基位置和官能团位置都不改变,CPPO的结构有( )
| A. | 32种 | B. | 36种 | C. | 64种 | D. | 72种 |
1.已知H-H、H-O和O═O键的键能分别为436kJ•mol-1,463kJ•mol-1,495kJ•mol-1,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=485 kJ•mol-1 | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=485 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-485 kJ•mol-1 |
15.六水合高氯酸铜[Cu(C1O4)2•6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解.实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下:
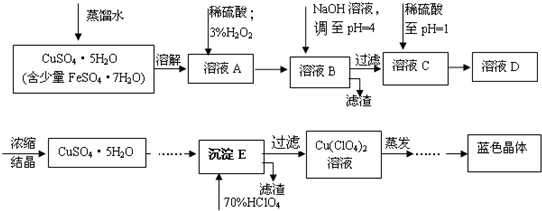
已知:
(1)写出A→B过程中发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
(2)溶液C中加入稀硫酸调至pH=1的目的是防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体.
(3)如欲检验溶液C中的杂质是否除净,其操作是取少量溶液,加入KSCN溶液(NH4SCN溶液),观察溶液是否仍然为蓝色.
(4)蒸发至有晶膜出现(填写现象),然后经过冷却结晶、过滤、洗涤、低温烘干(或自然干燥)(填写操作),得到纯净的蓝色晶体.
(5)为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、加水溶解、加入过量NaOH溶液、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.6348g.
(6)该样品的纯度为91.9%.如果样品的实际纯度为93.2%,则测定的相对误差为-1.4%.

已知:
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
(2)溶液C中加入稀硫酸调至pH=1的目的是防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体.
(3)如欲检验溶液C中的杂质是否除净,其操作是取少量溶液,加入KSCN溶液(NH4SCN溶液),观察溶液是否仍然为蓝色.
(4)蒸发至有晶膜出现(填写现象),然后经过冷却结晶、过滤、洗涤、低温烘干(或自然干燥)(填写操作),得到纯净的蓝色晶体.
(5)为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、加水溶解、加入过量NaOH溶液、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.6348g.
(6)该样品的纯度为91.9%.如果样品的实际纯度为93.2%,则测定的相对误差为-1.4%.
16.下列物质中只含有共价键的是( )
| A. | Na2O2 | B. | NaCl | C. | HCl | D. | Na2O |