题目内容
3.某溶质40%的溶液与水等体积混合后质量分数为19%,该溶质可能为( )| A. | 氯化镁 | B. | 氢氧化钠 | C. | 硫酸 | D. | 酒精 |
分析 设溶液和水的体积均为VmL,溶液的密度为ρg/mL,水的密度为1g/mL,根据ρ与1的大小关系判断.
解答 解:设溶液和水的体积均为VmL,溶液的密度为ρg/mL,水的密度为1g/mL,则溶液的质量为ρVg,水的质量为Vg,混合后溶质的质量分数为$\frac{ρV×40%}{ρV+V}$=$\frac{ρ}{ρ+1}×40%$,当溶液的密度ρ<1时,则$\frac{ρ}{ρ+1}×40%$<20%,当ρ>1时,$\frac{ρ}{ρ+1}×40%$>20%;已知混合后溶液的质量分数为19%,则该溶液的密度小于1,只有酒精符合,故D正确
故选D.
点评 本题考查质量分数的有关计算,题目难度不大,关键是根溶液的密度与水的密度的相对大小分析,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
18.有一在空气中暴露的NaOH固体,经分析测知其中含水2.8%,Na2CO37.2%,取3.50g该样品与1mol/L的盐酸100mL充分反应后,再用质量分数为37%的NaOH溶液中和过量的盐酸,将所得的溶液蒸干,所得的固体的质量为( )
| A. | 2.93g | B. | 3.51g | C. | 4.00g | D. | 5.85g |
15.在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4 中,已知Cu3P 中P为-3价,则15mol CuSO4可氧化的P的物质的量为( )
| A. | 1.5 mol | B. | 5.5 mol | C. | 3 mol | D. | 2.5 mol |
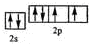 ,该元素的名称是氧;
,该元素的名称是氧;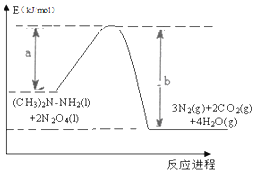 2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水. 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应: