��Ŀ����
6�� �о��������������ڴ����еĺ������ӵ������ʱ���漰���·�Ӧ��
�о��������������ڴ����еĺ������ӵ������ʱ���漰���·�Ӧ��2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g����K1��H1��0����
2NO��g��+Cl2��g��?2ClNO��g����K2��H2��0����
��1��4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g��
��ش��������⣺
��1��4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g��
�� ƽ �� �� ��K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$���� K 1��K 2 ��ʾ����
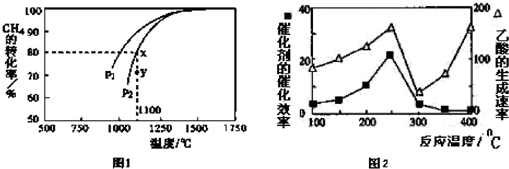
��2 ������Ӧ���ھ����ܱ������н��У�ʵ����NO2�� g ����ת������ʱ��仯��ʾ��ͼ��ͼ��ʾ��t3 ��t 4 ʱ�̣�NO2��g����ת���� ��NO2%�����͵�ԭ������ӦΪ���ȷ�Ӧ�ҷ�Ӧ����Ϊ�������������ŷ�Ӧ�Ľ��У���ϵ���¶Ȼ����ߣ����ٴδ�ƽ��ʱ��ת���ʻή�ͣ�
��3 ������Ӧ���ں��¡����������½��У��������жϸ÷�Ӧһ���ﵽƽ��״̬����AD��
A��������ѹǿ���ٱ仯
B��n �� ClNO ��=n �� NO ��
C����������ܶȲ���
D���� �� �� NO ��=�� �� �� ClNO ��
��4 ����һ���¶Ⱥ�ѹǿ�£���Ӧ��ﵽƽ�⣬�� NO�� Cl2 �ı�����ͬʱ���� Cl 2��ת���ʼ�ƽ�������� ClNO �������������Ӱ�죮�� NO �� Cl2 ��ʼ���ʵ���֮��Ϊ x��ƽ��ʱ Cl2 ��ת����Ϊ a��ƽ�������� ClNO ���������Ϊy���ж� a��x��y ���ߵ����ϵ���� a �� x �Ĵ���ʽ��ʾ y��y=$\frac{2a}{x+1-a}$��
��5��ʵ �� �� �� �� NaOH �� Һ �� �� NO2���� Ӧ Ϊ2NO2+2NaOH�TNaNO3+NaNO2+H2O���� 0.2molNaOH ��ˮ��Һ�� 0.2molNO2 ǡ����ȫ��Ӧ��1L��Һ A����ҺBΪ 0.1mol•L-1 ��CH 3 COONa ��Һ��������Һ�� c��NO3 - ����c�� NO2- ����c �� CH3COO- ���ɴ�С��˳��c��NO3-����c��NO2-����c��CH3COO-������֪ HNO 2 �ĵ��볣�� K 3=7.1��10-4 mol•L -1��CH3 COOH �ĵ��볣��K4=1.7��10-5 mol•L-1 ���������£�����Һ B �м�ˮϡ�����У����б�ֵ������a��b��c��
a��c��H+��/c��OH-��
b����OH-��/c�� CH3COO- ��
c��c��Na+��/c�� CH3COO- ��
d��c�� CH3COO- ��•c��H+��/c��CH3COOH��
���� ��1����֪����2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g����
��2NO��g��+Cl2��g��?2ClNO��g����
���ݸ�˹���ɢ١�2-�ڿɵã�4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��Ϊ�ٵ�ƽ�ⳣ��ƽ����ڵ��̣�
��2������Ӧ���ھ����ܱ������н��У�2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g����K1 ��H1��0����ӦΪ���ȷ�Ӧ����Ӧ�����¶����ߣ�
��3�����淴Ӧ�ﵽƽ��״̬��һ���������淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
��4���� NO �� Cl2 ��ʼ���ʵ���֮��Ϊ x��ƽ��ʱ Cl2 ��ת����Ϊ a����ϻ�ѧ���м�����ʽ������ƽ�������� ClNO ���������Ϊy������õ���
��5��0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ӦΪ2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���Һ��NaNO3���ʵ���Ũ��Ϊ0��mol/L��NaNO2���ʵ���Ϊ0.1mol/L����ҺBΪ0.1mol•L-1��CH3COONa��Һ����֪HNO2�ĵ��볣��Ka=7.1��10-4mol•L-1��CH3COOH�ĵ��볣��Ka=1.7��10-5mol•L-1��˵��CH3COOH����С��HNO2�����ԣ���Ӧ������ˮ��̶ȴݴ˷����жϣ�
��� �⣺��1��2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g�� K1 ��H��0 ��I��
2NO��g��+Cl2��g��?2ClNO��g�� K2 ��H��0 ��II��
���ݸ�˹���ɣ����2-��ɵã�4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$���ʴ�Ϊ��$\frac{{{K}_{1}}^{2}}{{K}_{2}}$��
��2������Ӧ���ھ����ܱ������н��У�2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g����K1 ��H1��0����ӦΪ���ȷ�Ӧ��ʵ����NO2�� g ����ת������ʱ��仯��ʾ��ͼ��t3��t 4 ʱ�̣�NO2��g����ת���� ��NO2%�����ͣ���ӦΪ���ȷ�Ӧ�ҷ�Ӧ����Ϊ�������������ŷ�Ӧ�Ľ��У���ϵ���¶Ȼ����ߣ����ٴδ�ƽ��ʱ��ת���ʻή�ͣ�
�ʴ�Ϊ����ӦΪ���ȷ�Ӧ�ҷ�Ӧ����Ϊ�������������ŷ�Ӧ�Ľ��У���ϵ���¶Ȼ����ߣ����ٴδ�ƽ��ʱ��ת���ʻή�ͣ�
��3��2NO��g��+Cl2��g��?2ClNO��g����K2��H2��0����ӦΪ���������С�ķ��ȷ�Ӧ��
A����Ӧǰ���������ʵ����仯��������ѹǿ���ٱ仯��˵����Ӧ�ﵽƽ��״̬����A��ȷ��
B��n �� ClNO ��=n �� NO ������˵�����淴Ӧ������ͬ������֤����Ӧ�ﵽƽ��״̬����B����
C��������������䣬�����������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬����C����
D����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ��� �� �� NO ��=�� �� �� ClNO ������ �� �� NO ��=�� �� �� ClNO ��˵��ClNO�����淴Ӧ������ͬ����D��ȷ��
�ʴ�Ϊ��AD��
��4���� NO �� Cl2 ��ʼ���ʵ���֮��Ϊ x��ƽ��ʱ Cl2 ��ת����Ϊ a����ϻ�ѧ���м�����ʽ��
2NO��g��+Cl2��g��?2ClNO��g��
��ʼ����mol�� x 1 0
�仯����mol�� 2a a 2a
ƽ������mol�� x-2a 1-a 2a
����ƽ�������� ClNO ���������Ϊy=$\frac{2a}{x+1-a}$��
�ʴ�Ϊ��y=$\frac{2a}{x+1-a}$��
��5��0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ӦΪ2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���ҺA��NaNO3���ʵ���Ũ��Ϊ0��mol/L��NaNO2���ʵ���Ϊ0.1mol/L����ҺBΪ0.1mol•L-1��CH3COONa��Һ����֪HNO2�ĵ��볣��Ka=7.1��10-4mol•L-1��CH3COOH�ĵ��볣��Ka=1.7��10-5mol•L-1��˵��CH3COOH����С��HNO2�����ԣ���Ӧ������ˮ��̶ȴ�������Ӻ������������ˮ�⣬����Һ��c��NO3-����c��NO2-����c��CH3COO-���ɴ�С��˳��Ϊ��c��NO3-����c��NO2-����c��CH3COO-����
��ҺBΪ0.1mol•L-1��CH3COONa��Һ�������£�����Һ B �м�ˮϡ�����У�
a��ϡ����������������Ũ�ȼ�С����Һ�д������ӻ���������������Ũ������$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$��ֵ����a��ȷ��
b����ˮϡ�ʹٽ�����$\frac{c��O{H}^{-}��}{c��C{H}_{3}COOH��}$��ֵ����b��ȷ��
c����Һ�м�ˮϡ�ͣ�$\frac{c��N{a}^{+}��}{c��C{H}_{3}CO{O}^{-}��}$=$\frac{n��N{a}^{+}��}{n��C{H}_{3}CO{O}^{-}��}$��������������ʵ�����С����ֵ����c��ȷ��
d��$\frac{c��C{H}_{3}CO{O}^{-}��c��{H}^{+}��}{c��C{H}_{3}COOH��}$Ϊ����ƽ�ⳣ������ʽ���¶Ȳ������ƽ�ⳣ�����䣬��d����
�ʴ�Ϊ��c��NO3-����c��NO2-����c��CH3COO-���� a��b��c��
���� ���⿼���˻�ѧƽ�ⳣ���ļ��㣬Ӱ�컯ѧƽ������ط���Ӧ�ã��������Һ������ˮ�⣬����Ũ�ȴ�С�Ƚϣ�������ҺPH�ķ��������жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

| A�� | �Ȼ�þ | B�� | �������� | C�� | ���� | D�� | �ƾ� |
| A�� | �ϳɰ���ҵ������ѹǿ����߷�Ӧ���ת���� | |
| B�� | ��������ֽ�Ӷ���������������ʹ��λʱ���ڲ��������������� | |
| C�� | ��ӦCO��g��+NO2��g���TCO2��g��+NO��g��������ӦΪ���ȷ�Ӧ������ƽ��������¶���ϵ��ɫ���� | |
| D�� | ����ɫ����ˮ���պ���ɫ��dz |
��1����ҵ������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g��???CH3OH��g����H=a kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H=b kJ•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g����H=c kJ•mol-1
���ڲ����¹��յ��ܷ�ӦΪ3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g�����÷�Ӧ�ġ�H=��2a+b+c��kJ•mol-1��ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OC{H}_{3}��c��C{O}_{2}��}{{c}^{3}��CO��{c}^{3}��{H}_{2}��}$��
��2������ѹǿ��CH3OCH3�IJ��������������С�����䡱����
��3��ԭ�����з�Ӧ�ٺͷ�Ӧ�ڷֱ��ڲ�ͬ�ķ�Ӧ���н��У���Ӧ�۷������¹����з�Ӧ�۵ķ��������CH3OCH3�IJ��ʣ�ԭ���Ƿ�Ӧ�������˷�Ӧ���еIJ���H2O��ʹ��Ӧ�ڵĻ�ѧƽ��������Ӧ�����ƶ����Ӷ����CH3OCH3�IJ��ʣ�
��4��Ϊ��Ѱ�Һ��ʵķ�Ӧ�¶ȣ��о��߽�����һϵ��ʵ�飬ÿ��ʵ�鱣��ԭ��������ɡ�ѹǿ����Ӧʱ������ز��䣬ʵ������ͼ��COת�������¶ȱ仯�Ĺ������¶ȵ���240��ʱ��CO��ת���������¶ȵ����߶������¶ȸ���240��ʱ��CO��ת���������¶ȵ����߶���С����ԭ�����ڽϵ���ʱ������Ӧ��ϵ��δ�ﵽƽ�⣬CO��ת������Ҫ�ܷ�Ӧ����Ӱ�죬�����¶ȵ����߷�Ӧ��������CO��ת����Ҳ�����ڽϸ���ʱ������Ӧ��ϵ���Ѵﵽƽ�⣬CO��ת������Ҫ�ܷ�Ӧ��Ӱ�죬�����¶ȵ�����ƽ�����淴Ӧ�����ƶ���CO��ת���ʼ�С����

��5����֪��Ӧ��2CH3OH��g��?CH3OCH3��g��+H2O��g��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/mol•L-1 | 0.64 | 0.50 | 0.50 |
������ʼֻ����CH3OH����10min��Ӧ�ﵽƽ�⣬ƽ��ʱCH3OH��ת���ʦ���CH3OH��=97.5%��
| A�� | 0.5mol/L | B�� | 0.01mol/L | C�� | 0.02mol/L | D�� | 0.05mol/L |