题目内容
13.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:(1)X元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3,它的元素符号是As;
(2)Y元素原子的价层电子的电子排布图为
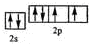 ,该元素的名称是氧;
,该元素的名称是氧;(3)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性,并说明理由稳定性为NH3>PH3>AsH3,因键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定.
分析 X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为O元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意,以此来解答.
解答 解:X的原子4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子.
(1)由上述分析可知,X元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,为As元素,故答案为:1s22s22p63s23p63d104s24p3;As;
(2)Y为O元素,原子基态时的电子排布式为1s22s22p4,其价电子的轨道表示式为 ,名称为氧,故答案为:
,名称为氧,故答案为: ;氧;
;氧;
(3)X为As元素,AsH3与NH3、PH3中,键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定,所以稳定性NH3>PH3>AsH3,
故答案为:稳定性为NH3>PH3>AsH3,因键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意电子排布及周期律的应用,题目难度不大.

| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 地下钢管连接锌板 |
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者(设18O℃在CH3CH2OH中),写出能表示18O位置的化学方程式CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示):CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇(或CaCl2•6C2H5OH);再加入无水硫酸钠,然后进行蒸馏,收集产品乙酸乙酯时,温度应控制在77.1℃左右.
| A. | 瓜皮果壳--可回收垃圾 | B. | 塑料--危险废物 | ||
| C. | 厨余垃圾--有机垃圾 | D. | 易拉罐--不可回收垃圾 |
| c(H2)/mol•L-1 | c(Cl2)/mol•L-1 | v/(mol•L-1•s-1) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
| A. | 氯化镁 | B. | 氢氧化钠 | C. | 硫酸 | D. | 酒精 |
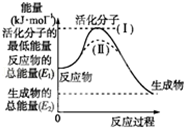 I.请认真观察图,然后回答问题.
I.请认真观察图,然后回答问题.