题目内容
12. 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.(1)还原沉淀法是处理含Cr2O72-和CrO42-工业废水的一种常用方法,其工艺流程为:CrO42-$\underset{\stackrel{{H}^{+}}{→}}{Ⅰ转化}$Cr2O72-$\frac{F{e}^{2+}}{Ⅱ还原}$Cr3+$\frac{O{H}^{-}}{Ⅲ沉淀}$Cr(OH)3↓
其中第Ⅰ步存在平衡:
2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
①若平衡体系的pH=0,该溶液显橙色.
②根据2CrO42-+2H+?Cr2O72-+H2O,设计如右图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7.Na2Cr2O7中铬元素的化合价为+6,图中右侧电极连接电源的正极,其电极反应式为4OH--4e-=O2↑+2H2O.
③第Ⅱ步反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3.完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4═□Cr2(SO4)3+□CH3COOH+□9H2O.
分析 (1)①根据氢离子对2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O平衡移动的影响判断;
②根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应生成三价铁离子和三价铬离子和水;
(2)根据化合价升降总数相等以及原子守恒来解答.
解答 解:(1)①若平衡体系的pH=0,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色,故答案为:橙;
②由化合价代数和为0可知Na2Cr2O7中铬元素的化合价为+6价,根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O,
故答案为:+6;正极;4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
故答案为:4;3;6;2;3;9H2O.
点评 本题综合考查了化学平衡原理、氧化还原反应、离子方程式的书写等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | 氯化镁 | B. | 氢氧化钠 | C. | 硫酸 | D. | 酒精 |
供选择的化学试剂及实验方法
A.氯化钡溶液
B.将溶液滴在pH试纸上
C.加入Na2CO3溶液,观察现象
D.加入足量铁粉,过滤
E.硫氰酸钾(KSCN)溶液
| 实验要求 | 选项的标号 |
| (1)证明粗盐中含有少量CaCl2 | |
| (2)鉴别Na2SO4溶液和NaCl溶液 | |
| (3)检验氯化亚铁是否变质 | |
| (4)证明某地雨水溶液呈酸性 | |
| (5)除去FeCl2溶液中的少量FeCl3 | 1 |
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |

 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).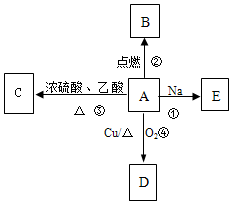 A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:
A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题: