题目内容
9.合金具有许多优良的物理、化学或机械性能.下列物质不属于合金的是( )| A. | 青铜 | B. | 钢 | C. | 硬铝 | D. | 玻璃 |
分析 合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等.
解答 解:A.青铜是铜锡合金,故A正确;
B.钢是铁与碳的合金,故B正确;
C.硬铝是铝的合金,故C正确;
D.玻璃是混合物,不含有金属单质,故D错误.
故选D.
点评 本题考查合金的特征,题目难度不大,掌握合金的特征是正确解答本题的关键.

练习册系列答案
相关题目
15.下列图示与对应的叙述不相符的是( )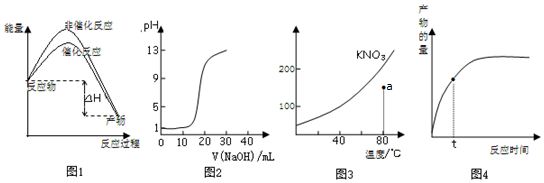

| A. | 图1表示加入催化剂不影响反应的焓变 | |
| B. | 图2表示用0.10mol/L CH3COOH溶液滴定20.00 mL0.10mol/LNaOH溶液所得到的滴定曲线 | |
| C. | 图3表示KNO3的溶解度曲线,图中点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 图4表示t时正反应速率大于逆反应速率 |
20.铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,有关该电池的说法正确的( )
| A. | 放电时,电解质溶液的pH不断降低且正负极均有PbSO4 生成 | |
| B. | 放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 | |
| C. | 充电时,阳极反应:PbSO4+2e-=Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
17.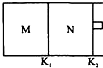 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
4.下列说法中正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 用玻璃棒蘸取新制氯水,点在pH试纸的中央,与标准比色卡比较,测定氯水的pH | |
| C. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
1.下列关于影响化学反应速率的因素中,说法错误的是( )
| A. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | 对于有气体参加的反应,增大压强,反应速度加快 | |
| D. | 恒容容器中,在气体反应体系中充入稀有气体,化学反应速率不发生改变 |
18.某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是( )
| A. | 溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 若溶液中部分粒子间满足:c(CH3COO-)=c(Na+),则该溶液一定呈中性 | |
| C. | 若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间可能满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
19.(1)除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
(2)某芳香族化合物的分子式为C7H8O,根据下列实验现象写出相应的结构简式:(要求:每小题只需给出一个答案即可.)
①不能与金属钠反应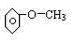 .
.
②能与钠反应,但遇FeCl3不显色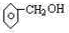 .
.
③能与钠反应且遇FeCl3显紫色 .
.
| 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 | |
| A | 苯(苯酚) | ||
| B | 乙酸乙酯(乙酸) | ||
| C | 乙醇(水) |
①不能与金属钠反应
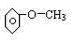 .
.②能与钠反应,但遇FeCl3不显色
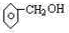 .
.③能与钠反应且遇FeCl3显紫色
 .
.