题目内容
8.下列反应的化学方程式书写正确的是( )| A. | 实验室制乙烯:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O | |
| B. | 苯酚钠溶液通入少量CO2:2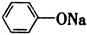 +CO2+H2O→2 +CO2+H2O→2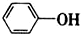 +Na2CO3 +Na2CO3 | |
| C. | 乙酸苯酚酯在足量的NaOH溶液中水解: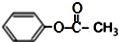 +NaOH→CH3COONa+ +NaOH→CH3COONa+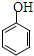 | |
| D. | 工业制聚乙烯:nCH2=CH2 $\stackrel{催化剂}{→}$ |
分析 A.实验室制备乙烯所用的原料为乙醇,乙醇在浓硫酸的催化作用下发生消去反应,分子内脱水生成乙烯;
B.苯酚钠通入二氧化碳生成苯酚和碳酸氢钠;
C.乙酸苯酚酯在足量的NaOH溶液中反应生成苯酚钠、乙酸钠;
D.聚乙烯中不含碳碳双键.
解答 解:A.实验室制乙烯:乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,反应为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O,故A正确;
B.碳酸的酸性比苯酚的酸性强,所以苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3,故B错误;
C.乙酸苯酚酯在足量的NaOH溶液中水解的反应为: ,故C错误;
,故C错误;
D.乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯,反应的化学方程式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查有机物化学反应方程式的书写,为高频考点,把握发生的化学反应及有机物结构与性质的关系为解答的关键,注意有机反应的条件,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
3.在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)?H2(g)+I2(g),2s 时生成0.1mol H2,则表示该时段的化学反应速率正确的是( )
| A. | v(HI)=0.8 mol•Lˉ1•sˉ1 | B. | v(I2)=0.2 mol•Lˉ1•sˉ1 | ||
| C. | v(HI)=0.1 mol•Lˉ1•minˉ1 | D. | v(H2)=0.05 mol•Lˉ1•sˉ1 |
16.中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示,则叙述正确的是( )


| A. | M的分子式为C9H8O4 | |
| B. | 1 mol M最多能与2 molBr2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |
3.NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝.
(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
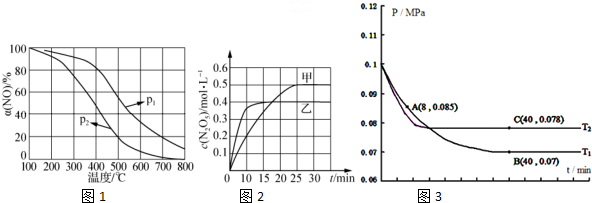
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
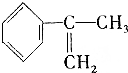
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
下列说法正确的是D.
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).

(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).
13.高中化学教材中有很多重要的演示或改编实验,就下列提供的几套装置回答有关问题:

(一)对于实验装置Ⅰ:
(1)用装置Ⅰ完成Al与NaOH溶液反应的实验,并验证生成的气体产物,在b中点燃气体之前,应该先进行验纯,验纯的具体操作为用小试管收集一试管氢气,点燃,听声音,若发出轻微的“噗”的声音,则说明氢气已纯,或发出尖锐的爆鸣声则说明氢气不纯.
(2)用装置Ⅰ还可以完成Na与乙醇反应及气体产物的检验实验:
Na与乙醇反应,理论上有H2生成,若将燃烧后的小烧杯倒转过来,迅速加入澄清石灰水,振荡,发现石灰水变浑浊,原因是氢气中混有乙醇蒸气.
(二)装置Ⅱ用于探究Cl2的漂白性和氧化性:
(3)仪器a的名称为分液漏斗
(4)关闭K1、打开K2,D中的现象为无明显变化.
(5)E中发生反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+;检验E中有无SO42-生成,用到的试剂有盐酸、氯化钡(填化学式).
(6)整个装置Ⅱ的明显不足之处在于没有尾气吸收装置.
(三)运用装置Ⅲ探究反应速率的影响因素:
(7)该组实验的目的是比较不同浓度的草酸对反应速率的影响;表中V=9mL
(8)有同学观察实验①过程中产生气泡的快慢,得出以下变化(如图甲):

则图甲中AB段变化的主要原因是锰离子对反应有催化作用;另有别的实验小组在完成Zn粒与稀硫酸反应的实验过程中,观察产生氢气的体积与时间的关系,有类似于图甲的规律,如图乙所示,则CD段变化的主要原因是使温度升高,反应速率增大.

(一)对于实验装置Ⅰ:
(1)用装置Ⅰ完成Al与NaOH溶液反应的实验,并验证生成的气体产物,在b中点燃气体之前,应该先进行验纯,验纯的具体操作为用小试管收集一试管氢气,点燃,听声音,若发出轻微的“噗”的声音,则说明氢气已纯,或发出尖锐的爆鸣声则说明氢气不纯.
(2)用装置Ⅰ还可以完成Na与乙醇反应及气体产物的检验实验:
Na与乙醇反应,理论上有H2生成,若将燃烧后的小烧杯倒转过来,迅速加入澄清石灰水,振荡,发现石灰水变浑浊,原因是氢气中混有乙醇蒸气.
(二)装置Ⅱ用于探究Cl2的漂白性和氧化性:
(3)仪器a的名称为分液漏斗
(4)关闭K1、打开K2,D中的现象为无明显变化.
(5)E中发生反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+;检验E中有无SO42-生成,用到的试剂有盐酸、氯化钡(填化学式).
(6)整个装置Ⅱ的明显不足之处在于没有尾气吸收装置.
(三)运用装置Ⅲ探究反应速率的影响因素:
| 试管编号 | 0.01mol/LKMnO4 | 0.5mol/LH2SO4 | 0.2mol/LH2C2O4 | H2O | 褪色时间/s |
| ① | 4mL | 5mL | 2mL | VmL | t1 |
| ② | 4mL | 5mL | 4mL | 7mL | t2 |
| ③ | 4mL | 5mL | 6mL | 5mL | t3 |
(8)有同学观察实验①过程中产生气泡的快慢,得出以下变化(如图甲):

则图甲中AB段变化的主要原因是锰离子对反应有催化作用;另有别的实验小组在完成Zn粒与稀硫酸反应的实验过程中,观察产生氢气的体积与时间的关系,有类似于图甲的规律,如图乙所示,则CD段变化的主要原因是使温度升高,反应速率增大.
17.晶体硼由105B和115B两种同位素原子构成.已知5.4g晶体硼全部转化成B2H6(硼烷)气体时,可得标准状况下5.6L硼烷,则下列说法正确的是( )
| A. | 晶体中105B和115B两种同位素原子的质量比为1:4 | |
| B. | 5.4 g该晶体硼所含中子为2.9 mol | |
| C. | 等质量的分别由105B和115B构成的晶体硼所含中子数之比为5:6 | |
| D. | 若碳原子质量为w g,则105B原子的质量为 $\frac{10w}{12}$g |
18.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法不正确的是( )
| A. | 18O 存在于水中 | |
| B. | 反应中浓硫酸即是催化剂又是脱水剂 | |
| C. | 18O 存在于乙酸乙酯中 | |
| D. | 若与丙酸反应生成的酯的相对分子质量为104 |
 、液溴、浓硫酸和其他无机试剂,请用5个化学方程式表示下列转化过程:
、液溴、浓硫酸和其他无机试剂,请用5个化学方程式表示下列转化过程: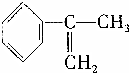 →
→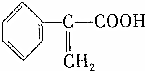
 ;
;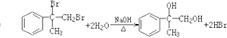 ;
; ;
; ;
;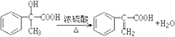 .
. ;
; ;
;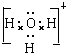 ;
;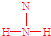 ;
;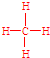 .
.