题目内容
12.下列关于醛的说法中正确的是( )| A. | 所有醛中都含醛基和烃基 | |
| B. | 一元醛的分子式符合CnH2nO的通式 | |
| C. | 醛的官能团是-COH | |
| D. | 所有醛都能使溴水和酸性KMnO4溶液褪色 |
分析 醛的通式为R-CHO,R可为H或烃基,含有醛基,可发生氧化反应、还原反应,以此解答该题.
解答 解:A.如为甲醛,则不含烃基,故A错误;
B.只有饱和一元醛的通式为CnH2nO,故B错误;
C.醛的官能团是-CHO,故C错误;
D.醛可被酸性高锰酸钾或溴水氧化,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握醛类的组成、结构和性质,能识别有机物的官能团,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝.
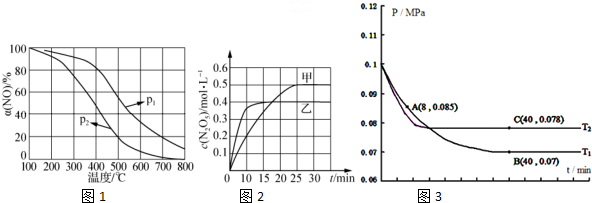
(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
下列说法正确的是D.
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).

(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).
7.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度
②升高温度
③增大压强
④移去生成物
⑤加入催化剂.
①增大反应物的浓度
②升高温度
③增大压强
④移去生成物
⑤加入催化剂.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②⑤ | D. | ①③④ |
17.晶体硼由105B和115B两种同位素原子构成.已知5.4g晶体硼全部转化成B2H6(硼烷)气体时,可得标准状况下5.6L硼烷,则下列说法正确的是( )
| A. | 晶体中105B和115B两种同位素原子的质量比为1:4 | |
| B. | 5.4 g该晶体硼所含中子为2.9 mol | |
| C. | 等质量的分别由105B和115B构成的晶体硼所含中子数之比为5:6 | |
| D. | 若碳原子质量为w g,则105B原子的质量为 $\frac{10w}{12}$g |
4.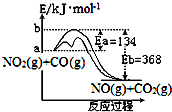 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
下列有关该反应的叙述错误的是( )
 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.| 实验序号 | 1 | 2 | 3 | 4 | |
| c(NO2)/mol•L-1 | 1 | 1 | 2 | 2 | |
| c(CO)/mol•L-1 | 1 | 2 | 1 | 2 | |
| v/mol•L-1•s-1 | 750K | p | 2p | 2p | 4p |
| 500K | q | q | 4q | 4q | |
| A. | 不同温度下,增加反应物的浓度不一定可以加快反应速率 | |
| B. | 加入催化剂,改变了反应的途径,加快了反应速率 | |
| C. | 升高反应温度,加快了反应速率,增大了平衡常数 | |
| D. | 750K时,将实验2的容器体积缩小一半,速率v为8p mol•L-1•s-1 |
2.已知三种有机物存在如下转化关系:
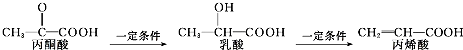
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol乳酸最多能与2molNa发生反应 | |
| D. | 三种有机物均能发生加聚反应 |
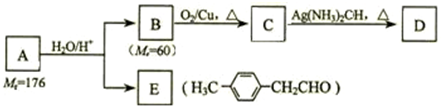
 .
. 、
、 、
、 (其中一种).
(其中一种).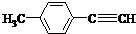 )的一条路线如下:
)的一条路线如下: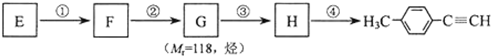
 ;
;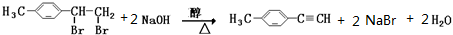 .
.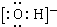 ;
;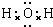 ;
;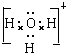 ;
;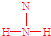 ;
;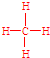 .
.