题目内容
18.下列实验操作或结论表述正确的是( )| A. | 中和滴定实验中,如用于装标准液的滴定管洗净、干燥后,未经润洗,测定结果偏高 | |
| B. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| C. | 纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 | |
| D. | 检验新鲜鸡血中的铁元素时,可在鸡血中加入稀硝酸并加热搅拌蒸干得到固体粉末,取少许粉末加入亚铁氰化钾稀溶液,可得蓝色溶液 |
分析 A.装标准液的滴定管洗净、干燥后,未经润洗,消耗的标准液偏多;
B.碘以离子形式存在,需要氧化生成碘单质;
C.有机溶剂作流动相,当流动相流过固定相时,各组分以不同的速度移动;
D.不是蓝色溶液,而是沉淀.
解答 解:A.装标准液的滴定管洗净、干燥后,未经润洗,消耗的标准液偏多,则待测液的浓度=$\frac{{c}_{标准}{V}_{标准}}{{V}_{待测}}$偏高,故A正确;
B.碘以离子形式存在,需要氧化生成碘单质,则实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取,故B错误;
C.纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度慢一些,故C错误;
D.新鲜鸡血中的铁元素化合价为+2价,可与亚铁氰化钾溶液反应生成沉淀,故D错误;
故选A.
点评 本题考查化学实验方案的评价,涉及纸层析实验、中和滴定、离子的检验等,侧重分析与实验能力的考查,注意实验基本操作和基本技能的应用,题目难度较大,综合性较强,选项AD均为解答的难点.

练习册系列答案
相关题目
8.日本核电站泄漏物中含有放射性的53131I.有关53131I的说法不正确是( )
| A. | 中子数为78 | B. | 质子数为53 | C. | 质量数为131 | D. | 核外电子数是78 |
9.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)?2Z(g),不能说明此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的百分含量不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | v正(X)=2v逆(Y) |
13.下列各项中表达正确的是( )
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 二氧化碳电子式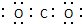 | |
| D. | 第三周期元素形成的简单离子中,半径最小的是Al3+ |
3.在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)?H2(g)+I2(g),2s 时生成0.1mol H2,则表示该时段的化学反应速率正确的是( )
| A. | v(HI)=0.8 mol•Lˉ1•sˉ1 | B. | v(I2)=0.2 mol•Lˉ1•sˉ1 | ||
| C. | v(HI)=0.1 mol•Lˉ1•minˉ1 | D. | v(H2)=0.05 mol•Lˉ1•sˉ1 |
10.锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗(Ge与碳同主族)元素处于最高价态,铋元素(Bi与氮同主族)的价态与它跟氯形成某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构.BGO的化学式是( )
| A. | Bi3Ge3O15 | B. | Bi4Ge3O12 | C. | Bi4Ge3O16 | D. | Bi3Ge3O12 |
3.NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝.
(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
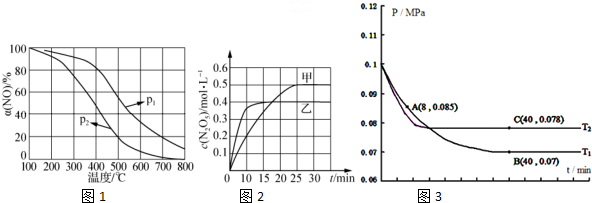
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
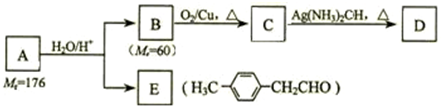
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
下列说法正确的是D.
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).

(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).
 .
. 、
、 、
、 (其中一种).
(其中一种).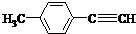 )的一条路线如下:
)的一条路线如下: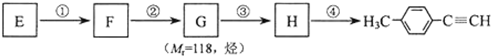
 ;
;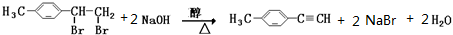 .
.