题目内容
20.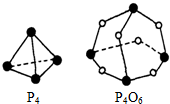 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
分析 热化学方程式中,焓变△H=反应物化学键总键能-生成物总键能,注意1molP4中含有6molP-P键,1molP4O6中含有12molP-O键,结合各化学键的键能列式计算热化学方程式P4(s)+3O2(g)═P4O6(s)的反应热△H.
解答 解:各化学键键能为P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1,
反应热△H=反应物总键能-生成物总键能,
所以反应P4(s)+3O2(g)═P4O6(s)的反应热△H=6×E1kJ•mol-1+3×E3kJ•mol-1-12×E2kJ•mol-1=(6E1+3E3-12E2)kJ•mol-1;
故答案为:(6E1+3E3-12E2)kJ•mol-1.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确“△H=反应物化学键总键能-生成物总键能”即可解答,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.200mL P%的盐酸(密度为ρg/cm3),其物质的量浓度的计算式正确的是( )
| A. | $\frac{200×P%×ρ}{36.5}$ | B. | $\frac{1000×P%×ρ}{36.5}$ | C. | $\frac{200×P%}{36.5}$ | D. | $\frac{ρ×P%}{1000×36.5}$ |
5.常温下某溶液中由水电离出的c(H+)为1.0×10-12mol•L-1,下列说法正确的是( )
| A. | 一定是酸的溶液 | B. | 一定是碱的溶液 | ||
| C. | 一定是碱性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
8.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式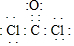
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).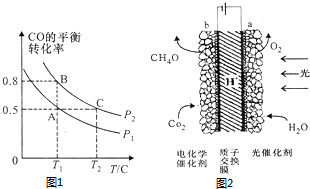
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
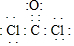
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
9.8g无水硫酸铜配成0.1mol•L-1的水溶液.下列说法正确的是( )
| A. | 溶于500 mL水中 | B. | 溶于1 L水中 | ||
| C. | 溶解后溶液的总体积为500 mL | D. | 溶解后溶液的总体积为1 L |
10.减缓温室气体排放是2009年哥本哈根气候变化会议的议题.下列反应不产生温室气体的是( )
| A. | 用氨制碳酸氢铵 | B. | 制普通玻璃 | ||
| C. | 用铁矿石炼铁 | D. | 汽车用乙醇汽油作燃料 |
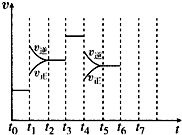 在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: