题目内容
5.现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的逆反应为放热反应,且m+n> p(填“>”、“=”或“<”).
(2)减压时,A的质量分数增大(填“增大”、“减小”或“不变”,下同).
(3)若容积不变加入B,则A的转化率增大,B的转化率减小.
(4)若升高温度,则平衡常数k将增大.
(5)若加入催化剂,平衡时气体混合物的总物质的量不变.
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色变深;而维持容器内压强不变,充入氖气时,混合物颜色变浅(填“变深”、“变浅”或“不变”).
分析 达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热;当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,根据外界条件对化学平衡的影响解答该题.
解答 解:(1)当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,逆反应为放热,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,说明m+n>p,故答案为:放;>;
(2)当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,所以A的质量分数增大,故答案为:增大;
(3)若保持容器体积不变,加入B,平衡正向移动,A的转化率增大,B的转化率减小,故答案为:增大;减小;
(4)反应吸热,升高温度,则K增大,故答案为:增大;
(5)若加入催化剂,平衡不会发生移动,平衡时气体混合物的总物质的量不变,故答案为:不变;
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时,平衡逆向移动,B的浓度增加,即混合物颜色变深;而维持容器内压强不变,充入氖气时,体积会增加,B的浓度减小,混合物颜色变浅,故答案为:变深、变浅.
点评 本题考查外界条件对平衡移动的影响,注意催化剂不影响平衡移动,题目难度不大.

练习册系列答案
相关题目
9.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 71 g Cl2所含原子数为2NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
10.下列反应中,观察不到颜色变化的是( )
| A. | 往氨水中滴加酚酞 | B. | NO气体暴露在空气中 | ||
| C. | Cl2通过湿润的有色布条 | D. | 往NaOH溶液中通入CO2 |
10.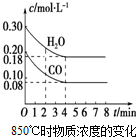 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol•(L•min)-1.
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
①若c1数值大于0.08mol•L-1,则温度t>850℃(填“>”“<”或“=”).
②表中3~4min之间反应处于平衡 状态.
③若第5min时,该反应处于化学平衡状态,则此反应的平衡常数K=0.35(保留两位有效数字)
④表中5~6min之间数值发生变化,可能的原因是B.
A.升高温度
B.体积不变,通入水蒸气
C.缩小体积,增大压强
D.体积不变,通入氢气
⑤比较反应物CO在2~3min、5~6min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)表示]的大小v(2~3)>v(5~6)(假设3~5min内反应条件不变).
⑥能使该反应的反应速率增大,且平衡向正反应方向移动的措施是C.
A.适当升高温度 B.缩小反应容器的体积C.增大CO的浓度 D.选择高效催化剂.
 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0(1)在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol•(L•min)-1.
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.110 | 0.210 | 0.090 | |
| 6 | 0.096 | 0.266 | 0.104 |
②表中3~4min之间反应处于平衡 状态.
③若第5min时,该反应处于化学平衡状态,则此反应的平衡常数K=0.35(保留两位有效数字)
④表中5~6min之间数值发生变化,可能的原因是B.
A.升高温度
B.体积不变,通入水蒸气
C.缩小体积,增大压强
D.体积不变,通入氢气
⑤比较反应物CO在2~3min、5~6min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)表示]的大小v(2~3)>v(5~6)(假设3~5min内反应条件不变).
⑥能使该反应的反应速率增大,且平衡向正反应方向移动的措施是C.
A.适当升高温度 B.缩小反应容器的体积C.增大CO的浓度 D.选择高效催化剂.
17.以苯为原料,不能通过一步反应制得的有机物是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列物质一定属于同系物的是( )
①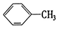 ②
②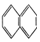 ③
③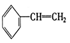 ④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦
④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦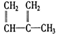 ⑧
⑧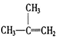
①
 ②
② ③
③ ④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦
④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦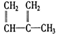 ⑧
⑧
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
15.若用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,32 g 臭氧中含有2NA个氧原子 | |
| B. | 标准状况下,22.4 L CCl4中含有的分子数为NA | |
| C. | 23 g钠离子中含有的电子数为NA | |
| D. | Zn+2H+=Zn2++H2↑ 2mol H+被氧化时转移2mol 电子 |
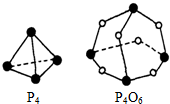 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).