题目内容
4.200mL P%的盐酸(密度为ρg/cm3),其物质的量浓度的计算式正确的是( )| A. | $\frac{200×P%×ρ}{36.5}$ | B. | $\frac{1000×P%×ρ}{36.5}$ | C. | $\frac{200×P%}{36.5}$ | D. | $\frac{ρ×P%}{1000×36.5}$ |
分析 根据c=$\frac{1000ρw}{M}$计算该盐酸的物质的量浓度.
解答 解:c=$\frac{1000ρw}{M}$=$\frac{1000×ρg/L×P%}{36.5g/mol}$=$\frac{1000×P%×ρ}{36.5}$mol/L,故B正确.
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度概念及表达式即可解答,注意把握物质的量浓度和质量分数之间的换算,试题培养了学生灵活运用基础知识的能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
1.下列做法与社会可持续发展理念相违背的是( )
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用资源节约型、环境友好型的生物降解塑料包装袋 |
15. 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上 2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成下列问题:
(1)正确操作步骤的顺序是B、D、C、E、A、F(填字母序号).
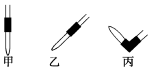
(2)如图,排除碱式滴定管中气泡的方法应采用操作丙(填图编号),轻轻挤压玻璃球使尖嘴部分充满碱液.
(3)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(4)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果偏高(填“偏高”、“偏低”或“不变”).
(5)判断到达滴定终点的实验现象是滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色.
(6)重复上述滴定2~3次,记录数据如表:
根据表中数据,可计算出该盐酸的浓度约为0.09mol/L(保留两位小数).
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:A.移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上 2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成下列问题:
(1)正确操作步骤的顺序是B、D、C、E、A、F(填字母序号).
(2)如图,排除碱式滴定管中气泡的方法应采用操作丙(填图编号),轻轻挤压玻璃球使尖嘴部分充满碱液.
(3)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(4)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果偏高(填“偏高”、“偏低”或“不变”).
(5)判断到达滴定终点的实验现象是滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色.
(6)重复上述滴定2~3次,记录数据如表:
| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
12.下列反应中,不属于氧化还原反应的是( )
| A. | H2+F2═2HF | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑ |
19.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,48gO3含有的氧原子数为3NA | |
| B. | 1 mol OH-所含的电子数为9NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 物质的量浓度为1mol/L MgCl2溶液,含有Cl-离子数为2NA |
9.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 71 g Cl2所含原子数为2NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
16.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 32 g O2气体含有的氧原子数为NA | |
| B. | 2 L 0.3 mol/L Na2SO4溶液中含有Na+为0.6NA | |
| C. | 54 g铝完全反应后失去的电子数为6NA | |
| D. | 11.2 L氮气所含的分子数为0.5NA |
13.沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+O2(g)═CO2(g)+H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ•mol-1 |
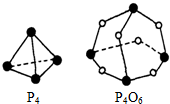 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).