题目内容
8.N、C、S元素的单质及化合物在工农业生成中有着重要的应用Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
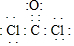
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
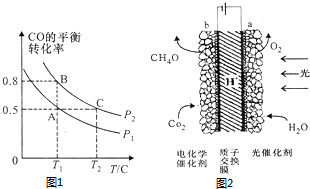
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
分析 I.(1)结构式为: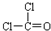 ,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对;
,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对;
(2)2min内参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,生成n(COCl2)=n(CO)(反应)=0.40mol,则v(COCl2)=$\frac{\frac{△n}{V}}{△t}$;
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)?COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=$\frac{0.80mol}{2L}$=0.40mol/L、c(Cl2)=$\frac{0.20mol}{2L}$=0.10mol/L、c(COCl2)=$\frac{0.40mol}{2L}$=0.20mol/L,
化学平衡常数K=$\frac{c(COC{l}_{2})}{c(CO).c(C{l}_{2})}$;
(3)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
②相同温度下,增大压强平衡正向移动,CO转化率增大;
③A、B反应温度相等,则平衡常数相等,利用平衡常数计算;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$×②得反应CO(g)+2H2(g)=CH3OH(l),焓变进行相应的改变;
(2)①电解池中阴离子向阳极移动、阳离子向阴极移动;
②b电极上二氧化碳得电子和氢离子反应生成甲醇.
解答 解:I.(1)结构式为: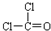 ,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为
,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为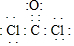 ,故答案为:
,故答案为: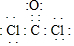 ;
;
(2)2min内参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,生成n(COCl2)=n(CO)(反应)=0.40mol,则v(COCl2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.40mol}{2L}}{2min}$=0.1mol/(L.min);
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)?COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=$\frac{0.80mol}{2L}$=0.40mol/L、c(Cl2)=$\frac{0.20mol}{2L}$=0.10mol/L、c(COCl2)=$\frac{0.40mol}{2L}$=0.20mol/L,
化学平衡常数K=$\frac{c(COC{l}_{2})}{c(CO).c(C{l}_{2})}$=$\frac{0.20}{0.40×0.10}$=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)?COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=$\frac{0.25}{0.25×0.75}$=$\frac{4}{3}$,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)?COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=$\frac{\frac{8}{V}}{\frac{2}{V}×\frac{12}{V}}$=$\frac{4}{3}$,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$×②得反应CO(g)+2H2(g)=CH3OH(l),△H=(-283.0kJ•mol-1
)+(-286kJ•mol-1)-$\frac{2}{3}$(-726.5kJ•mol-1)=-126.57kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol;
(2)①电解池中阴离子向阳极移动、阳离子向阴极移动,所以氢离子向阴极b移动,故答案为:b;
②b电极上二氧化碳得电子和氢离子反应生成甲醇,电极反应式为6H++CO2+6e-=CH3OH+H2O,
故答案为:6H++CO2+6e-=CH3OH+H2O.
点评 本题考查较综合,涉及化学平衡计算、电解池原理、盖斯定律、化学平衡状态判断等知识点,侧重考查学生分析、判断、计算能力,明确化学反应原理是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,注意:化学平衡常数只与温度有关,与反应物转化率及物质浓度无关.

| A. | H2+F2═2HF | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑ |
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+O2(g)═CO2(g)+H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ•mol-1 |
| A. | 往氨水中滴加酚酞 | B. | NO气体暴露在空气中 | ||
| C. | Cl2通过湿润的有色布条 | D. | 往NaOH溶液中通入CO2 |
 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.(1)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与 0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的 CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
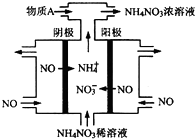
(3)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是根据反应:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
| A. |  | B. | 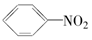 | C. | 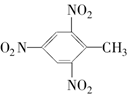 | D. |  |
| A. | 乙烯 | B. | 苯 | C. | 甲苯 | D. | 乙酸 |
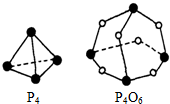 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).