题目内容
17.X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,在周期表中Y与X、Z、Q相邻,Q与X最高能层上的电子数相同,W原子核外有七种不同能级的电子,且最高能级上没有未成对电子,W与X可形成W2X和WX两种化合物.回答下列问题:
(1)X能与原子序数最小的元素形成原子个数比为1:1的分子,该分子的电子式为
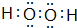 .
.(2)W 2+的核外电子排布式为1s22s22p63s23p63d9.
(3)Z单质能溶于水,水液呈黄绿 色,在其中通人Y的某种氧化物,溶液颜色褪去,用化学方程式表示原因Cl2+SO2+2H2O=2HCl+H2SO4.
(4)Y、Z元素的第一电离能Y< Z(填“>”、“<”或“=”). X与地壳中含量第二的元素形成的化合物所属的晶体类型为原子晶体.
(5)已知X分别与元素碳、氮形成化合物有如下反应:
2CX(g)+X2(g)═2CX2(g)△H=-566.0kJmol -1
N2(g)+X2(g)═2NX(g)△H=+189.5kJmol -1
2NX(g)+X2(g)═2NX2(g)△H=-112.97kJmol -1
写出NX2与CX反应生成大气中存在的两种气态物质的热化学方程式:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1.
(6)Y与磷原子形成P4Y3分子,该分子中没有π键,且各原子最外层均已达8电子结构,则一个P4Y3分子中含有的极性键和非极性键的个数分别为6个、3个.
分析 X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,则X为O元素,Q与X最高能层上的电子数相同,二者同主族,Y和X、Z、Q均相邻,故X、Y、Q同族,且Y在中间,则Y为硫,Q为硒,又Y、Z相邻,且Z的原子序数大于Y,故Z为氯,W有7个能级,分别为1s、2s、2p、3s、3p、3d、4s,且最高能级没有未成对电子,则3d能级上有10个电子,根据其形成的两种氧化物确定W为铜.
(1)O能与原子序数最小的元素H形成原子个数比为1:1的分子H2O2;
(2)Cu原子的4s能级、3d能级各失去1个电子形成Cu2+;
(3)Z的单质为氯气,水溶液呈黄绿色;在氯水中通人SO2,发生氧化还原反应,溶液颜色褪去;
(4)同一周期从左至右第一电离能呈增大起始;SiO2为典型的原子晶体.
(5)根据盖斯定律可以计算得到反应热,写出热化学方程式;
(6)可以想象为在P4(正四面体结构)分子中的每个P-P键中放入一个S原子,故有6个极性键、3个非极性键.
解答 解:X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,则X为O元素,Q与X最高能层上的电子数相同,二者同主族,Y和X、Z、Q均相邻,故X、Y、Q同族,且Y在中间,则Y为硫,Q为硒,又Y、Z相邻,且Z的原子序数大于Y,故Z为氯,W有7个能级,分别为1s、2s、2p、3s、3p、3d、4s,且最高能级没有未成对电子,则3d能级上有10个电子,根据其形成的两种氧化物确定W为铜.
(1)O能与原子序数最小的元素H形成原子个数比为1:1的分子H2O2,电子式为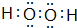 ,
,
故答案为: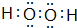 ;
;
(2)Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(3)Z的单质为氯气,水溶液呈黄绿色;在氯水中通入SO2,发生氧化还原反应,溶液颜色褪去,反应方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:黄绿色;Cl2+SO2+2H2O=2HCl+H2SO4;
(4)同一周期从左至右第一电离能车呈增大趋势,故第一电离能S<Cl;SiO2为典型的原子晶体,
故答案为:<;原子晶体;
(5)已知:①.2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
②.N2(g)+O2(g)═2NO(g)△H=+189.5kJ•mol-1
③.2NO(g)+O2(g)═2NO2(g)△H=-112.97kJ•mol-1
根据盖斯定律,①×2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1,
故答案为:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1;
(6)可以想象为在P4(正四面体结构)分子中的每个P-P键中放入一个S原子,故有6个极性键、3个非极性键,
故答案为:6;3.
点评 本题以元素推断为载体,考查原子结构、分子结构、元素周期律、元素及化合物、热化学方程式的书写、盖斯定律等知识,注意对基础知识的理解掌握.

| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,若H的一种同位素中子数为5,则其原子符号是${\;}_{5}^{10}$B,B元素的原子结构示意图是
 ;
;(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物F2A2的电子式是:
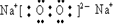 .
.(3)用电子式表示F2I的形成过程:
 ;
;(4)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则乙极的电极反应式为:O2+4e-+2H2O=4OH-.
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |
| A. | O | B. | F | C. | S | D. | Cl |
| 选项 | 实验操作 | 现象 | 结论 |
| A | NH4HSO3受热分解产生的气体全部通入Ba(NO3)2溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| B | 浓度均为0.1mol•L-1Zn2+和Cu2+混合溶液中滴入少量Na2S溶液 | 产生黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 2mLpH=3的盐酸和2mLpH=3醋酸,同时分别加入足量相同的锌粉 | 反应速率不同 | 较快的为盐酸 |
| D | 待测液X中加入KSCN溶液无明显现象,加入H2O2酸性溶液 | 溶液变为红色 | X中含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
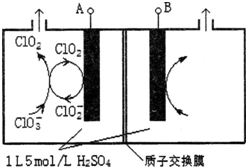 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.