题目内容
13.下列各组物质:①Cu与HNO3溶液②Cu与FeCl3溶液③Zn与H2SO4溶液④Fe与HCl溶液,由于溶液浓度不同而能发生不同反应的是( )| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
分析 硝酸、硫酸的浓度不同,性质不同,与金属发生反应时,发生不同的氧化还原反应,以此解答该题.
解答 解:①Cu与HNO3溶液中,若为浓硝酸,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,若为稀硝酸,则发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,故正确;
②Cu与FeCl3溶液中,无论浓度大小都只发生Cu+2FeCl3═2FeCl2+CuCl2,故错误;
③Zn与H2SO4溶液中,若为稀硫酸,发生Zn+H2SO4═ZnSO4+H2↑,若为浓硫酸,则发生Zn+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$ZnSO4+SO2↑+2H2O,故正确;
④Fe与HCl溶液中,无论浓度大小都只发生Fe+2HCl=FeCl2+H2↑,故错误.
故选A.
点评 本题考查常见物质的性质,明确浓稀硝酸、浓硫酸具有强氧化性及发生的化学反应是解答本题的关键,注意相关方程式的书写,难度中等.

练习册系列答案
相关题目
6.同位素的不同核素具有不同的( )
| A. | 核电荷数 | B. | 质子数 | C. | 中子数 | D. | 电子数 |
1.下列对第ⅣA族元素及其化合物的性质的推断一定不正确的是( )
| A. | 与同族硅元素类似,锗、锡、铅都可用做半导体材料 | |
| B. | 锗与盐酸可能不反应,锡、铅能与盐酸反应 | |
| C. | 锗、锡、铅的+4价氢氧化物的碱性由弱到强的顺序为:Ge(OH)4<Sn(OH)4<Pb(OH)4 | |
| D. | 锗、锡、铅的金属性依次减弱 |
8.金属铜与浓硫酸反应的方程式中Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O.下列说法正确的是( )
| A. | Cu是氧化剂 | B. | H2SO4在反应中只表现氧化性 | ||
| C. | Cu在反应中被氧化 | D. | 1mol氧化剂在反应中得到1mol电子 |
18.已知反应:2A(g)+B(g)?2C(g)△H=-196KJ/mol,某温度下,向一体积为2L的密闭容器中充入0.2molA和0.1molB,5min后达到平衡,共放出热量17.64KJ.下列说法正确的是( )
| A. | 5min内用B表示的反应速率为0.018mol/(L•min) | |
| B. | 在该温度下反应的平衡常数为900 | |
| C. | A和B的平衡转化率都为90% | |
| D. | 如果加压,平衡正向移动,可使△H 减小 |

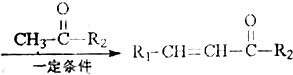 +H2O
+H2O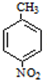 ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.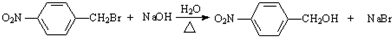 .
.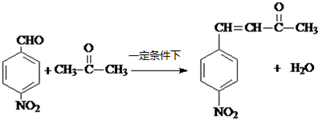 .
.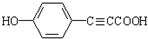 .
.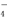 =5SO2-4+2Mn2+ +3H2O
=5SO2-4+2Mn2+ +3H2O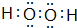 .
.