题目内容
15.等质量的两块金属钠,一块直接投入水中,一块用刺有小孔的铝箔包好后投入水中(水均为足量),生成氢气( )| A. | 前者多 | B. | 后者多 | C. | 一样多 | D. | 无法判断 |
分析 将钠用铝箔包好并刺一些小孔,再放入足量的水中,首先是钠与水反应生成NaOH和氢气,铝与NaOH溶液反应生成氢气,由此分析解答.
解答 解:将钠用铝箔包好并刺一些小孔,再放入足量的水中,首先是钠与水反应生成NaOH和氢气,铝与NaOH溶液反应生成氢气,所以后者生成的氢气多,故选B.
点评 本题考查元素化合物知识,特别是钠和铝的化学性质,题目难度不大,注意铝既能与酸反应又能与碱反应的性质.

练习册系列答案
相关题目
5.下列说法中,正确的是( )
| A. | 0.1mol/L醋酸钙溶液中,c (Ca 2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 体积和pH 都相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 | |
| C. | 将nmolH2(g)、nmol I2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,该溶液的pH一定为14-a |
6.下列说法正确的是( )
| A. | 常温下,将pH=2的HA溶液与pH=12的BOH溶液等体积混合后,溶液的pH<7,则BA为强酸弱碱盐 | |
| B. | 弱电解质溶液稀释后,溶液中各离子浓度一定都减小 | |
| C. | 常温下,向体积相同pH均为1的盐酸和醋酸溶液中分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 常温下,将pH均为13的NaOH溶液和氨水分别加水稀释100倍后,氨水的碱性强于NaOH溶液 |
10.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24LO2中含有的共键数为0.4NA | |
| B. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数0.2NA | |
| C. | 100g质量分数为16.2%HBr溶液中的氢原子数为NA | |
| D. | 3.9gNa2O2晶体中所含的离子总数为0.5NA |
20.第十届亲水胶体国际会议于2010年6月20日到24日在上海举行,专家学者共同研讨亲水胶体和应用领域中关注的问题,下列说法错误的是( )
| A. | 利用丁达尔效应可区分溶液与胶体 | |
| B. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在10-9~10-7m之间 | |
| C. | 胶体分散质粒子能透过半透膜和滤纸 | |
| D. | Fe(OH)3胶体吸附水中的悬浮颗粒并沉降,达到净水的目的 |
4.Na2O2与CO2反应能够产生O2,这一反应在呼吸面具、潜水艇及太空飞船中可为人提供呼吸所用的O2.下面对该反应的说法中正确的是( )
| A. | 这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂 | |
| B. | 这是一个氧化还原反应,Na2O2是氧化剂,CO2是还原剂 | |
| C. | 这是一个氧化还原反应,Na2O2是还原剂,CO2是氧化剂 | |
| D. | 这是一个置换反应,有单质O2产生 |
5.将5.6g的Zn-Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体.再向所得溶液中加入适量的NaOH溶液,产生15.8g沉淀.根据题意推断气体x的成分可能是( )
| A. | 0.3molNO2和0.3molNO | |
| B. | 0.1mol NO、0.2molNO2和0.05mol N2O4 | |
| C. | 0.2molNO2 和0.1molN2O4 | |
| D. | 0.6molNO |
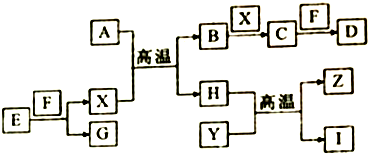
 .
. 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知: