题目内容
10.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,2.24LO2中含有的共键数为0.4NA | |
| B. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数0.2NA | |
| C. | 100g质量分数为16.2%HBr溶液中的氢原子数为NA | |
| D. | 3.9gNa2O2晶体中所含的离子总数为0.5NA |
分析 A、求出氧气的物质的量,然后根据1mol氧气中含2mol共价键来分析;
B、H2S和SO2中均含1个硫原子;
C、HBr溶液中除了HBr外,水也含氢原子;
D、求出过氧化钠的物质的量,然后根据1mol过氧化钠由2mol钠离子和1mol过氧根构成来分析.
解答 解:A、标况下2.24L氧气的物质的量为0.1mol,而1mol氧气中含2mol共价键,故0.1mol氧气中含0.2mol共价键即0.2NA个,故A错误;
B、H2S和SO2中均含1个硫原子,故0.1molH2S和0.1molSO2混合后,体系中的硫原子为0.2mol即0.2NA个,故B正确;
C、HBr溶液中除了HBr外,水也含氢原子,故溶液中的氢原子的个数大于NA个,故C错误;
D、3.9g过氧化钠的物质的量为0.05mol,而1mol过氧化钠由2mol钠离子和1mol过氧根,故0.05mol过氧化钠中含0.1mol钠离子和0.05mol过氧根即共0.15mol,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
11.下列叙述中正确的是( )
| A. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| B. | 用硝酸酸化的硝酸银溶液能一次鉴别NaCl,NaBr,KI三种失去标签的溶液 | |
| C. | 某溶液中加入CCl4,CC14层显紫色,证明原溶液中存在I- | |
| D. | 某浅黄色的溴水,加入CC14震荡静置后,上层显橙红色 |
18.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止富脂食品氧化变质,延长食品的保持期,在包装袋中放入抗氧化物质,下列属于抗氧化物质的是( )
| A. | 生石灰 | B. | 还原铁粉 | C. | 氯化钙 | D. | 硫酸钡 |
15.等质量的两块金属钠,一块直接投入水中,一块用刺有小孔的铝箔包好后投入水中(水均为足量),生成氢气( )
| A. | 前者多 | B. | 后者多 | C. | 一样多 | D. | 无法判断 |
2.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 | |
| D. | 煤的干馏和石油的分馏均属化学变化 |
19.下列实验所对应的现象和结论均正确,且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 常温下,将光亮的铁钉投入足量浓硝酸中,充分反应后滴加KSCN溶液 | 有大量红棕色气体产生,溶液变为血红色 | 铁还原浓硝酸生产NO2,铁被氧化为Fe3+ |
| B | 将氨气缓缓通入到少量AlCl3溶液中 | 先出现沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物,可溶解在碱溶液中 |
| C | 向乙酸钠溶液中滴入酚酞,微热 | 溶液先出现红色,后红色变深 | CH3COO-水解使溶液显碱性,水解反应是吸热反应 |
| D | 将装满氯水的圆底烧瓶倒置在盛有水的水槽中,日光照射 | 烧瓶内有气泡生成 | 日光照射时,溶解在水中的Cl2 |
| A. | A | B. | B | C. | C | D. | D |
20.向含有下列离子的溶液中分别加入烧碱固体(溶液的体积变化可忽略),能引起离子浓度增大的是( )
| A. | OH- | B. | Cl- | C. | Cu2+ |
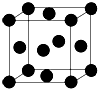 用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简).
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简).