题目内容
8.表是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 _.
_.(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是
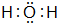 (填该物质的电子式).
(填该物质的电子式).(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).
分析 由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Mg,⑥为Al,⑦为Si,⑧为S,⑨为Cl,⑩为Ar.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体化学性质最不活泼;元素⑨对应的离子为Cl-,核外电子数为18,各层电子数为2、8、8;
(2)同周期自左而右原子半径减小;
(3)非金属性越强,对应氢氧化物越稳定,H2O比硫化氢稳定;
(4)金属性越强,最高价氧化物对应水化物的碱性越强;
(5)③与⑦形成的化合物为二氧化碳等,碳原子与氧原子之间形成共价键,属于分子晶体.
解答 解:由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Mg,⑥为Al,⑦为Si,⑧为S,⑨为Cl,⑩为Ar.
(1)稀有气体Ar的化学性质最不活泼,同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,金属性最强的元素是镁,最活泼的非金属单质是F2,元素⑨对应的离子为Cl-,核外电子数为18,离子结构示意图为 ,
,
故答案为:Ar;镁;F2; ;
;
(2)同周期自左而右原子半径减小,故第二周上述元素中F原子半径最小,
故答案为:F;
(3)非金属性O>S,非金属性越强,对应氢氧化物越稳定,故H2O比硫化氢稳定,H2O的电子式为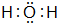 ,
,
故答案为: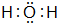 ;
;
(4)金属性Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故Mg(OH)2的碱性更强,
故答案为:Mg(OH)2;
(5)③与⑦形成的化合物为二氧化碳等,碳原子与氧原子之间形成共价键,属于分子晶体,
故答案为:共价;分子.
点评 本题考查元素周期表与元素周期律综合应用,侧重对元素周期律与化学用语的考查,注意掌握金属性、非金属强弱比较实验事实.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
18.下表是元素周期表的一部分,回答下列问题:
(1)上表中,可用来制作半导体材料的物质的组成元素是Si(填元素符号).
(2)S元素的最高正化合价是+6.
(3)Na、Mg、Al三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第ⅦA族,该元素的原子结构示意图是c(选填编号).
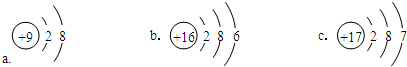
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
(2)S元素的最高正化合价是+6.
(3)Na、Mg、Al三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第ⅦA族,该元素的原子结构示意图是c(选填编号).
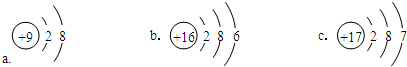
19.与氢氧根具有相同的质子数和电子数的微粒是( )
| A. | CH4 | B. | NH4 + | C. | NH2- | D. | Cl- |
16.短周期元素A、B、C、D在周期表中的位置关系如图所示.已知在同周期元素的常见简单离子中,D的离子半径最小,E是周期表中半径最小的原子
回答下列问题:
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为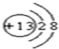
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为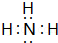 ,Y的结构式为
,Y的结构式为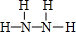
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
| A | B | C | |
| D |
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为

(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
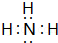 ,Y的结构式为
,Y的结构式为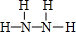
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
20.下列物质中,不属于卤代烃的是( )
| A. | 硝基苯 | B. | 溴苯 | C. | 四氯化碳 | D. | 氯乙烯 |
18.下列各组物质的性质比较中不正确的是( )
| A. | 氧化性:F2>C12>Br2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 熔沸点:SiO2>NaCl>CO2 | D. | 热稳定性:SiH4>PH3>H2S |
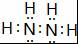 ;
;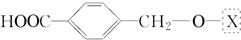 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.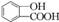 .
. 任意2种.
任意2种.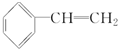 为主要原料制备
为主要原料制备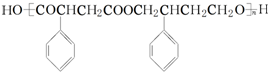 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).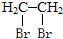
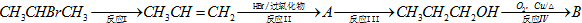 请回答下列问题:
请回答下列问题: