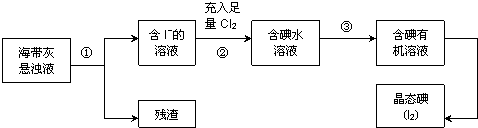
题目内容
18.下表是元素周期表的一部分,回答下列问题:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
(2)S元素的最高正化合价是+6.
(3)Na、Mg、Al三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第ⅦA族,该元素的原子结构示意图是c(选填编号).
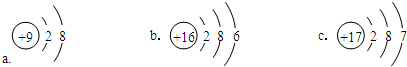
分析 (1)可用来制作半导体材料的物质的组成元素是Si;
(2)主族元素最高正化合价等于主族族序数;
(3)同周期自左而右金属性减弱;
(4)元素位于元素周期表中第3周期第ⅦA族,原子核外有3个电子层,最外层电子数为7.
解答 解:(1)上述元素中,Si具有一定的金属性、非金属性,可用来制作半导体材料,故答案为:Ai;
(2)S元素处于VIA族,高正化合价为+6,故答案为:+6;
(3)同周期自左而右,原子半径减小、核电荷数增大,原子核对核外电子吸引增大,原子失去电子的能力减弱,金属性减弱,故答案为:减弱;
金属性减弱,故金属性
(4)元素位于元素周期表中第3周期第ⅦA族,原子核外有3个电子层,最外层电子数为7,结合核外电子排布规律,可知该元素的原子结构示意图是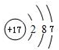 ,故选:c.
,故选:c.
点评 本题考查结构性质位置关系应用,比较基础,注意从结构上理解同周期、同主族元素的相似性与递变性.

练习册系列答案
相关题目
13.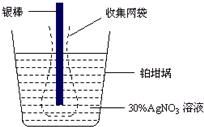 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂棒上发生的电极反应式为:2H++NO3-+e-=NO2↑+H2O | |
| B. | 已知每摩尔电子的电量为96 500 C,若反应进行10分钟,称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中的平均电流约为9.65A | |
| C. | 若要测定电解精炼铜时通过的电量,可将银电量计中的银棒与待测电解池的精铜电极相连 | |
| D. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏低 |
13.下列说法错误的是( )
| A. | 只用水可以鉴别甲苯和四氯化碳 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 乙醇分子中不含有OH- | |
| D. | 95%的乙醇溶液常用于医疗消毒 |
3.下列有关金属的工业制法中,不正确的是( )
| A. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| B. | 制镁:用海水为原料,经一系列过程制得氯化镁固体,电解熔融的氯化镁得镁 | |
| C. | 制铁:以铁矿石为原料,CO还原得铁 | |
| D. | 制铝:从铝土矿中获得氧化铝,提纯后电解熔融的氧化铝得到铝 |
7.下列关于铷( Rb)的叙述中正确的是( )
| A. | 位于第四周期、第ⅠA 族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
8.表是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
(1)在这10种元素中,化学性质最不活泼的元素是Ar(填元素符号),金属性最强的元素是镁(填元素名称),最活泼的非金属单质是F2(化学式),元素⑨对应的离子结构示意图为 _.
_.
(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是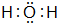 (填该物质的电子式).
(填该物质的电子式).
(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 _.
_.(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是
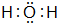 (填该物质的电子式).
(填该物质的电子式).(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).