题目内容
18.下列各组物质的性质比较中不正确的是( )| A. | 氧化性:F2>C12>Br2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 熔沸点:SiO2>NaCl>CO2 | D. | 热稳定性:SiH4>PH3>H2S |
分析 A、元素的非金属性越强,对应的单质的氧化性越强;
B、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C、一般来说熔沸点点:原子晶体>离子晶体>分子晶体;
D、元素的非金属性越强,对应的氢化物越稳定.
解答 解:A、非金属性F>Cl>Br,元素的非金属性越强,对应的单质的氧化性越强,故A正确;
B、非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故B正确;
C、一般来说熔点:原子晶体>离子晶体>分子晶体,SiO2为原子晶体,NaCl为离子晶体,CO2为分子晶体,故C正确;
D、非金属性S>P>Si,元素的非金属性越强,对应的氢化物越稳定,SiH4<PH3<H2S,故D错误;
故选D.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
8.表是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
(1)在这10种元素中,化学性质最不活泼的元素是Ar(填元素符号),金属性最强的元素是镁(填元素名称),最活泼的非金属单质是F2(化学式),元素⑨对应的离子结构示意图为 _.
_.
(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是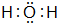 (填该物质的电子式).
(填该物质的电子式).
(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 _.
_.(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是
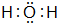 (填该物质的电子式).
(填该物质的电子式).(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).
9.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
| A. | 2Na2O2+2H2O=4NaOH+O2 | B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | ||
| C. | Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ | D. | NH4Cl+NaOH=NaCl+H2O+NH3↑ |
13.下列变化属于取代反应的是( )
| A. | CH≡CH+HCl→CH2=CHCl | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. |  | D. |  |
10.某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品,经了解其来源并查阅相关资料(如下表),初步确认为铜制品.
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究.
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是青铜表面长出了铜绿(只写一个).
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是油漆是有机物,可燃.
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是青铜中含有金属锡,能与盐酸反应生成氢气.
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验.

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了白色固体变蓝色的现象,C中观察到了澄清石灰水变浑浊的现象.
B中所发生反应的化学方程式为:CuSO4+5H2O=CuSO4•5H2O.
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是无法确定分解产物中是否有水.
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:Cu2(OH)2CO3+8NH3•H2O=2Cu(NH3)42++2OH-+CO32-+8H2O.
| 紫铜 | 青铜 | 铜绿 | |
| 主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
| 性质与用途 | 紫红色,质软,导电性能良好;主要用作电线电缆. | 多呈灰绿色,熔点低、硬度大、可塑性强;可铸造成各种器具. | 不溶于水的灰绿色粉末,溶于酸,加热易分解;可作颜料、杀虫剂. |
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是青铜表面长出了铜绿(只写一个).
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是油漆是有机物,可燃.
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是青铜中含有金属锡,能与盐酸反应生成氢气.
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验.

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了白色固体变蓝色的现象,C中观察到了澄清石灰水变浑浊的现象.
B中所发生反应的化学方程式为:CuSO4+5H2O=CuSO4•5H2O.
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是无法确定分解产物中是否有水.
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:Cu2(OH)2CO3+8NH3•H2O=2Cu(NH3)42++2OH-+CO32-+8H2O.
7.某有机物的结构简式为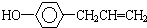 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
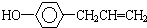 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 该有机物所有原子均可在同一平面上 | |
| B. | 1mol该有机物最多可与4mol溴发生反应 | |
| C. | 该有机物核磁共振氢谱有6组峰,峰面积比为1:1:2:2:2:2 | |
| D. | 该有机物在水中的溶解度大于苯酚在水中的溶解度 |
8.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | B与A只能组成BA3化合物 | |
| B. | C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 | |
| C. | A、B、C形成的化合物一定不能发生水解 | |
| D. | E的氧化物对应的水化物一定有强的氧化性 |
