题目内容
19.与氢氧根具有相同的质子数和电子数的微粒是( )| A. | CH4 | B. | NH4 + | C. | NH2- | D. | Cl- |
分析 氢氧根离子中质子数为各元素的质子数之和,一个氢氧根离子中的质子数是9个,电子数是10个.
解答 解:氢氧根具有9个质子和10个电子.
A、CH4具有10个质子和10个电子,二者不相同,故A错误;
B、NH4+具有11个质子和10个电子,二者不相同,故B错误;
C、NH2-具有9个质子和10个电子,二者相同,故C正确;
D、Cl-具有17个质子和18个电子,二者不相同,故D错误;
故答案为:C.
点评 本题考查微粒的质子数和电子数,明确原子序数与质子数、电子数的关系即可解答,注意阳离子失去电子,阴离子得到电子来解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列关于铷( Rb)的叙述中正确的是( )
| A. | 位于第四周期、第ⅠA 族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
14.下列式子能表示羟基的是( )
①OH- ②-OH ③ ④
④
①OH- ②-OH ③
 ④
④
| A. | 只有② | B. | 只有①和② | C. | 只有②和③ | D. | ①②③④ |
4.某元素Z的核外电子数等于核内中子数,取其单质2.8g 与O2完全反应,可得6g化合物ZO2,Z 元素在周期表中位置是( )
①第3周期 ②第2周期 ③第ⅣA 族 ④第ⅤA族.
①第3周期 ②第2周期 ③第ⅣA 族 ④第ⅤA族.
| A. | ②④ | B. | ①④ | C. | ①③ | D. | ②③ |
11.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
8.表是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
(1)在这10种元素中,化学性质最不活泼的元素是Ar(填元素符号),金属性最强的元素是镁(填元素名称),最活泼的非金属单质是F2(化学式),元素⑨对应的离子结构示意图为 _.
_.
(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是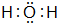 (填该物质的电子式).
(填该物质的电子式).
(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 _.
_.(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是
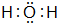 (填该物质的电子式).
(填该物质的电子式).(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).
9.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
| A. | 2Na2O2+2H2O=4NaOH+O2 | B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | ||
| C. | Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ | D. | NH4Cl+NaOH=NaCl+H2O+NH3↑ |