题目内容
3.X、Y、Z、W、M、N 为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体.X与M,W与N分别同主族,在周期表中X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,Z、W 的最外层电子数之和与M的核外电子总数相等.试回答下列问题:(1)N的核外电子空间运动状态有16种;电子占据的最高能级符号是3p;所在能层排满有18个电子;
(2)X、Z 形成的含18电子的化合物的电子式为
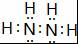 ;
;(3)X和W组成的化合物中,既含有极性共价键又含有非极性共价键的是H2O2(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:OH-+CN-+H2O2=CO32-+NH3↑;
(4)ZX3和YX4两种分子在X2W中的溶解度相差很大,其原因是CH4为非极性分子,NH3为极性分子,H2O为极性溶剂,根据相似相容原理,NH3在水中的溶解度大,且NH3与H2O可形成分子间氢键,增大NH3在H2O中的溶解度.
分析 X、Y、Z、W、M、N为原子序数依次增大的六种短周期元素,在周期表中X是原子半径最小的元素,则X为氢元素;X与M同主族,结合原子序数可知M为Na;Y、Z、W的原子序数小于M,处于第二周期,X能与Y、Z、W分别形成电子数相等的三种分子,考虑10电子分子等,为C、N、O、F中的3种,六种元素单质中三种为气体、三种为固体,而Y、Z、W的单质只有至少有2种气体单体,又W与N同主族,则N属于固体,故W不能为F元素,而Z、W的最外层电子数之和与M的核外电子总数相等,则平均最外层电子数为5.5,Z最外层电子数为5、W最外层电子数为6,可推知Y为C、Z为N、W为O,W与N同主族,则N为S元素.
解答 解:X、Y、Z、W、M、N为原子序数依次增大的六种短周期元素,在周期表中X是原子半径最小的元素,则X为氢元素;X与M同主族,结合原子序数可知M为Na;Y、Z、W的原子序数小于M,处于第二周期,X能与Y、Z、W分别形成电子数相等的三种分子,考虑10电子分子等,为C、N、O、F中的3种,六种元素单质中三种为气体、三种为固体,而Y、Z、W的单质只有至少有2种气体单体,又W与N同主族,则N属于固体,故W不能为F元素,而Z、W的最外层电子数之和与M的核外电子总数相等,则平均最外层电子数为5.5,Z最外层电子数为5、W最外层电子数为6,可推知Y为C、Z为N、W为O,W与N同主族,则N为S元素.
(1)N为S元素,原子核外有16个单质,故核外电子空间运动状态有16种,电子占据的最高能级符号是3p,所在能层排满有18个电子,
故答案为:16;3p;18;
(2)X、Z 形成的含18电子的化合物为N2H4,电子式为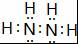 ,
,
故答案为: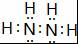 ;
;
(3)X和W组成的化合物中,既含有极性共价键又含有非极性共价键的是 H2O2,此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:OH-+CN-+H2O2=CO32-+NH3↑,
故答案为:H2O2;OH-+CN-+H2O2=CO32-+NH3↑;
(4)CH4为非极性分子,NH3为极性分子,H2O为极性溶剂,根据相似相容原理,NH3在水中的溶解度大,且NH3与H2O可形成分子间氢键,增大NH3在H2O中的溶解度,
故答案为:CH4为非极性分子,NH3为极性分子,H2O为极性溶剂,根据相似相容原理,NH3在水中的溶解度大,且NH3与H2O可形成分子间氢键,增大NH3在H2O中的溶解度.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,是对学生综合能力的考查,注意基础知识的理解掌握.

| A. | 只用水可以鉴别甲苯和四氯化碳 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 乙醇分子中不含有OH- | |
| D. | 95%的乙醇溶液常用于医疗消毒 |
①OH- ②-OH ③
 ④
④
| A. | 只有② | B. | 只有①和② | C. | 只有②和③ | D. | ①②③④ |
| A. | 从C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
(1)该反应的离子方程式为5H2C2O4十2MnO4-十6H+=2Mn2+十10CO2↑十8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是反应生成的锰离子起了催化作用
若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?
不可行(填可行或不可行)若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应
③还有一组同学改变KMnO4酸性溶液的浓度,做了下表中实验
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | V2 | 6.4 |
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 _.
_.(2)给出的第二周期的几种元素中,原子半径最大的是F (填元素符号).
(3)元素③与⑧的气态氢化物中较稳定的物质是
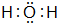 (填该物质的电子式).
(填该物质的电子式).(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是Mg(OH)2(填化学式).
(5)元素③与⑦能以共价键(填化学键类型)结合成分子晶体(填晶体类型).
| A. | 在电解制备磷酸亚铁锂的过程中,阳极的电极反应式为:Fe+H2PO4-+Li+-2e-═LiFePO4+2H+ | |
| B. | 放电过程中Li+向负极移动,充电过程中Li+向阴极移动 | |
| C. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| D. | 该锂电池放电时正极反应式为FePO4+Li++e-═LiFePO4 |
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
| A. | CH≡CH+HCl→CH2=CHCl | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. |  | D. |  |