题目内容
15.标准状况下,将一充满HCl气体的烧瓶倒扣在盛有水的水槽中,HCl气体被完全吸收,假设溶液没有损失,则烧瓶内所得溶液的物质的量浓度为( )| A. | 0.045 mol/L | B. | 1 mol/L | C. | 0.5 mol/L | D. | 2.24mol/L |
分析 HCl溶于水,溶液体积等于HCl的体积,设HCl的体积为VL,利用n=$\frac{V}{{V}_{m}}$计算HCl物质的量,再根据c=$\frac{n}{V}$计算所得溶液物质的量浓度.
解答 解:HCl溶于水,溶液体积等于HCl的体积,设HCl的体积为VL,n(HCl)=$\frac{V}{{V}_{m}}$,c(HCl)=$\frac{n}{V}$=$\frac{\frac{V}{{V}_{m}}mol}{VL}$=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L=0.045 mol/L,故选A.
点评 本题考查物质的量浓度的计算,明确气体体积、溶液体积与烧瓶容积的关系是关键,侧重考查学生分析计算能力,难度不大.

练习册系列答案
相关题目
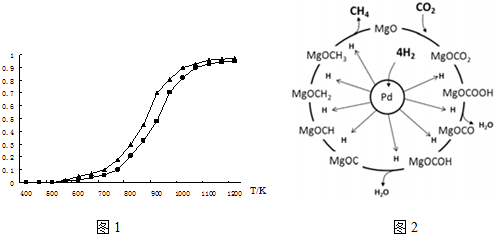
3. 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
回答下列问题:
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0.容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(3)t分钟后容器III达到平衡,t>20s(填“>”“<”或“=”).判断的理由是甲醇的起始浓度相同,但容器I的温度大于容器III的温度.
请在图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0.容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(3)t分钟后容器III达到平衡,t>20s(填“>”“<”或“=”).判断的理由是甲醇的起始浓度相同,但容器I的温度大于容器III的温度.
请在图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
10.“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如表:
请回答:①c1=c2(填“>”、“<”或“=”);a=19.6.
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol/(L•s).
(2)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n (NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母).

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如表:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol/(L•s).
(2)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n (NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母).

20.下列说法正确的是( )
| A. | 淀粉、纤维素、蔗糖和麦芽糖水解的最终产物都是葡萄糖 | |
| B. | 可以用Na2CO3溶液或者NaOH溶液除去乙酸乙酯中的乙酸和乙醇 | |
| C. | 天然油脂是混合物,主要成分是饱和和不饱和的高级脂肪酸 | |
| D. | 蛋白质溶液中加入Na2SO4可使其析出,再加水蛋白质又会重新溶解 |
5.实验中的下列操作正确的是( )
| A. | 进行蒸馏操作时冷凝管进水的方向是上进下出 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |