题目内容
14.(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4═ZnSO4+Cu①负极材料锌;电解质溶液CuSO4溶液.
②写出电极反应式:正极:Cu2++2e-=Cu;
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气1.12L(标准状况下).导线中通过0.1mol电子.
分析 (1)原电池电池反应式中,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据电池反应式确定正负极和电解质溶液;
(2)锌、铜和稀硫酸构成的原电池中,根据转移电子相等计算生成氢气体积,根据锌和转移电子之间的关系式计算电子物质的量.
解答 解:(1)①原电池电池反应式中,负极上失电子发生氧化反应,正极上得电子发生还原反应,该原电池中,Zn失电子发生氧化反应,则Zn是负极、不如锌活泼的金属或导电的非金属作正极,硫酸铜溶液作电解质溶液,
故答案为:锌;CuSO4溶液;
②正极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)该原电池中,锌失电子发生氧化反应,正极上氢离子发生还原反应,根据转移电子相等知,生成氢气体积=$\frac{\frac{3.25g}{65g/mol}}{2}×2$×22.4L/mol=1.12L,
每个Zn原子在反应中失去2个电子,所以转移电子物质的量=$\frac{3.25g}{65g/mol}×2$=0.1mol,
故答案为:1.12;0.1.
点评 本题考查原电池设计,为高频考点,明确正负极材料判断方法、各个物理量之间的关系是解本题关键,侧重考查学生分析判断及计算能力,题目难度不大.

练习册系列答案
相关题目
19.苯环和侧链相互影响,下列关于甲苯的实验事实中,能说明苯环对侧链有影响的是( )
| A. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| B. | 1 mol甲苯能与3 mol H2发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾褪色 | |
| D. | 甲苯能燃烧产生带浓烟的火焰 |
6.下列有关物质的表述中正确的是( )
| A. | 18O的原子结构示意图: | B. | 中子数为8的氮原子:${\;}_{8}^{15}$N | ||
| C. | 次氯酸的电子式: | D. | NH4+的结构式: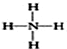 |
3.某高聚物的结构如图所示,下列说法正确的是( )


| A. | 该高聚物为加聚产物 | B. | 该高分子为体型高分子 | ||
| C. | 该高分子的单体有6种 | D. | 该高分子中含有酯基 |
4.用R代表短周期元素,R最外层的2p能级上的未成对电子有3个,下列关于R的描述正确的是( )
| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
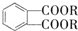 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
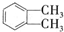 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.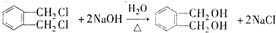 .
. .
.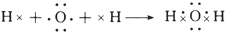 .
.