题目内容
19.化学与生产生活、环境保护、资源利用、能源开发等密切相关.下列说法错误的是( )| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
分析 A.开发和利用新能源可以减少化石燃料的燃烧;
B.减少机动车尾气的排放,可减少氮氧化物的排放;
C.氮和磷是植物的营养元素;
D.任何物质都是化学物质.
解答 解:A.开发推广太阳能、水能、风能等能源,可减少煤、石油等化石燃料的使用,有利于节能减排、改善环境质量,故A正确;
B.氮氧化物是形成雾霾的一个原因,减少机动车尾气的排放,可减少氮氧化物的排放,故B正确;
C.氮和磷是植物的营养元素,可造成水体富营养化,故C正确;
D.绿色食品是指在无污染的条件下种植、养殖、施有机肥料、不用高毒性、高残留农药、在标准环境、生产技术、卫生标准下加工生产、经权威机构认定并使用专门标志的安全、优质、营养类食品的统称;任何物质都是化学物质,故D错误.
故选D.
点评 本题考查较综合,涉及物质的性质与用途、环境污染及保护、水体富营养化等,注重化学与生活、环境的联系,侧重基础知识的考查,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
9.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色.
实验流程如下:
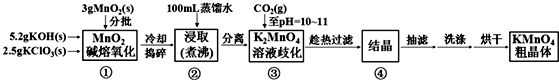
请回答:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
③下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①实验时先将草酸晶体(H2C2O4•2H2O)配成标准溶液,实验室常用的容量瓶规格有100mL、250mL等多种,现配制90mL 1.5mol•L-1的草酸溶液,需要称取草酸晶体的质量为18.9g.
②量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
实验流程如下:

请回答:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
③下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①实验时先将草酸晶体(H2C2O4•2H2O)配成标准溶液,实验室常用的容量瓶规格有100mL、250mL等多种,现配制90mL 1.5mol•L-1的草酸溶液,需要称取草酸晶体的质量为18.9g.
②量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
10.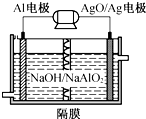 铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
 铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )| A. | OH-向Al电极移动 | |
| B. | 正极的电极反应式:O2+2H2O+4e-═4OH- | |
| C. | Al电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 当电极上析出0.54 g Ag时,电路中转移的电子为0.005 mol |
7.下列各组微粒中,质子数和电子数均相等的是( )
| A. | Na+和He | B. | H2O和D2O | C. | NH4+和NH3 | D. | H2SO4和H3PO4 |
14.某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象.请帮助该同学整理并完成实验报告.
(1)实验目的:研究同周期金属元素性质递变规律.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
(3)写出实验①和④对应化学方程式
实验①Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
实验④2Al+6HCl=2AlCl3+3H2↑.
(4)实验结论:第三周期元素随着核电荷数的递增,金属性逐渐减弱.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
实验①Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
实验④2Al+6HCl=2AlCl3+3H2↑.
(4)实验结论:第三周期元素随着核电荷数的递增,金属性逐渐减弱.
11.有五个系列的同族元素的物质,101.3kPa时测定的沸点(℃)如表所示:
对应表中内容,下列叙述中不正确的是( )
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)5.7 | I2184.0 |
| ③ | (c)19.4 | HCl-84.0 | HBr-67.0 | HI-35.5 |
| ④ | H2O100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、e的化学式分别为Ne、Br2、SnH4 | |
| B. | 系列②物质均有氧化性,系列③物质对应水溶液均是强酸 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>(d)>H2Te | |
| D. | 上表内的物质(c)和H2O,由于氢键的影响,其熔沸点在同族中特别高 |
8.下列各数值表示有关元素的原子序数,其中能以共价键相互结合形成稳定化合物的是( )
| A. | 8与11 | B. | 9与9 | C. | 2和19 | D. | 6与8 |
 .
.